Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi hh X thành Fe và Fe2O3
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O (1)
0.2 mol 0.3 mol
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O (2)
nSO2 = 6.72 / 22.4 = 0.3 (mol)
Theo pthh (1) nFe = 2/3 nSO2 = 2/3 . 0.3 = 0.2 mol
=>mFe = 0.2 X 56 = 11.2 (g)
=>mFe2O3 = 49.6 - 11.2=38.4 (g)
=>nFe2O3 = 38.4 / 160 = 0.24 mol
=> nO (trong Fe2O3) = 3 X nFe2O3 = 3 X 0.24 =0.72 (mol)
(vì n(nguyên tố ) = n(chất) X hệ số nguyên tố nên ta có nO = nFe2O3 X hệ số 3 của O )
%mO (hh X ) = (0.72 X 16 X 100)/49.6 = 23.23 %

\(n_{SO_2}=\dfrac{13,644}{22,4}=0,61\left(mol\right)\)
Đặt n Fe = x (mol) =>\(m_{Fe}=56x\)
Vì m Fe = mMg => \(n_{Mg}=\dfrac{56x}{24}=\dfrac{7}{3}x\)
nAl = y(mol)
=> 56x + 56x + 27y = 16,14 (1)
\(Fe\rightarrow Fe^{3+}+3e\) \(S^{+6}+2e\rightarrow S^{+4}\)
\(Mg\rightarrow Mg^{2+}+2e\)
\(Al\rightarrow Al^{3+}+3e\)
Bảo toàn e : 3x + \(\dfrac{7}{3}.2x\) + 3y = 0,61.2 (2)
Từ (1), (2) => x=0,12 ; y=0,1
=> mFe =mMg=0,12.56 = 6,72(g)
m Al = 0,1.27=2,7(g)

Gọi $n_{Fe} = a ; n_{Mg} = b; n_{Al} = c$
Ta có :
$24b = 56a(1)$
$56a + 24b + 27c = 16,14(2)$
$n_{SO_2} = 0,61(mol)$
Bảo toàn electron : $3n_{Fe} + 2n_{Mg} + 3n_{Al} = 2n_{SO_2}$
$\Rightarrow 3a + 2b + 3c = 0,61.2(3)$
Từ (1)(2)(3) suy ra a = 0,12 ; b = 0,28 ; c = 0,1
$m_{Fe} = m_{Mg} = 0,12.56 = 6,72(gam)$
$m_{Al} = 0,1.27 = 2,7(gam)$

Câu 1
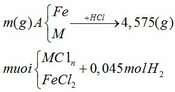
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
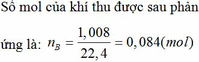
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
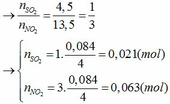
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
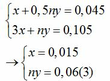
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

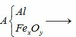
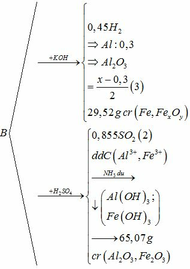
Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)
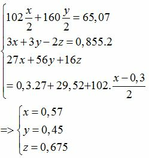
=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb
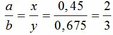
=> Fe2O3

Cách này ko cần viết phương trình :3
Quy đổi hh gồm Fe (a mol) và O (b mol)
\(\Rightarrow56a+16b=30\) (1)
Ta có: \(n_{NO}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+3n_{NO}\) \(\Rightarrow3a-2b=0,75\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,45\\b=0,3\end{matrix}\right.\)
Vì mFe trong oxit cũng là mFe ban đầu \(\Rightarrow m_{Fe}=0,45\cdot56=25,2\left(g\right)\)
*Sửa đề: Tính %m của Oxi
Với bài này thì ko cần viết phương trình đâu bạn nhé :))
Coi hỗn hợp A gồm Fe (a mol) và O (b mol) \(\Rightarrow56a+16b=49,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+2n_{SO_2}\) \(\Rightarrow3a-2b=0,8\) (2)
Từ (1) và (2) \(\Rightarrow\) \(\left\{{}\begin{matrix}a=0,7\\b=0,65\end{matrix}\right.\) \(\Rightarrow\%m_O=\dfrac{0,65\cdot16}{49,6}\cdot100\%\approx20,97\%\)