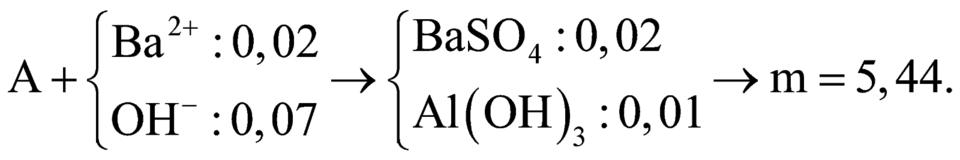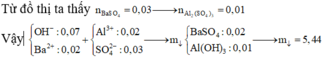Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tham khảo:
– Dung dịch Ba(OH)2 dư nên Al(OH)3 sinh ra rồi tan hết.
– Phèn amoni (NH4)2SO4.Al2(SO4)3.24H2O: 0,1 mol
⟹ nSO42- = 0,4 mol và nNH4+ = 0,2 mol
Kết tủa Y : Ba2+ + SO42-→ BaS04 ↓
→m↓ = mBaSO4= 0,4.233 = 93,2 (g)
Khí Z : NH4 + + OH– → NH3↑+H2O
⟹ VNH3 = 0,2.22,4 = 4,48 (lít).
Hoà tan phèn nhôm vào nước thu được dung dịch A chứa K2SO4, Al2(SO4)3.
Thêm NH3 vào A đến dư:
3NH3 + Al2(SO4)3 + H2O → (NH4)2SO4 + Al(OH)3
(dung dịch amoniac có tính bazơ nên có khả năng tạo kết tủa hiđroxit với muối nhôm, tuy nhiên tính bazơ không đủ mạnh nên không thể hoà tan được tiếp Al(OH)3 như các bazơ mạnh khác)
Thêm Ba(OH)2 vào dung dịch thu được
K2SO4 + Ba(OH)2 → BaSO4 + 2KOH
Ba(OH)2 + Al(OH)3 → Ba(AlO2)2 + H2O
(NH4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3 + 2H2O
Kết tủa B: BaSO4, có thể có Al(OH)3 dư (do đề bài không cho Ba(OH)2 dư hay không)
Dung dịch D: KOH, Ba(AlO2)2
Sục CO2 đến dư vào dung dịch D:
CO2 + 2KOH → K2CO3 + H2O
CO2 + K2CO3 + H2O → 2KHCO3
2CO2 + Ba(AlO2)2 + 2H2O → Ba(HCO3)2 + Al(OH)3

Đáp án A.
Thí nghiệm thu được kết tủa là: (1); (2); (4); (5); (6); (8).
(1) ![]()
![]()
(2) 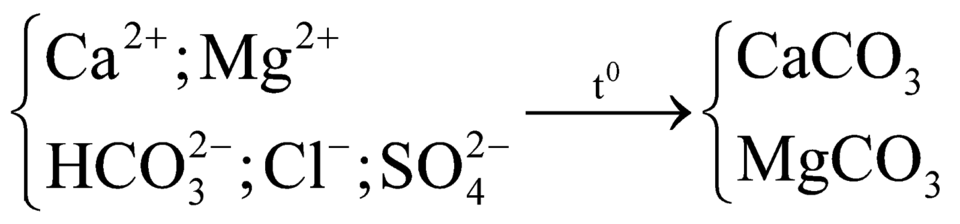
(3) Không hiện tượng, do nước cứng vĩnh cửu chứa ![]() .
.
(4) ![]()
![]()
(5) 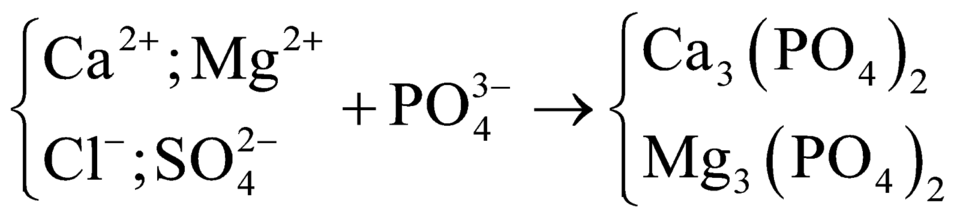
(6) ![]()
(7) ![]()
(8) ![]()

Đáp án B
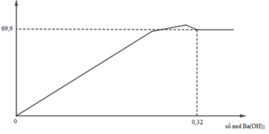
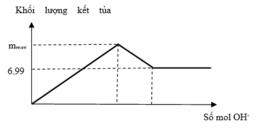
Ta có sơ đồ phản ứng sau:
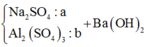
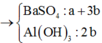
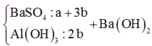
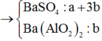
+ Từ sơ đồ trên ta có hệ phương trình:
PT theo số mol của BaSO4: a + 3b = 69,9÷233 = 0,3 (1)
PT bảo toàn Bari: a + 3b + b = a + 4b = 0,32 (2)
+ Giải hệ (1) và (2) ta có a = nNa2SO4 = 0,24 mol