Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi % đồng vị 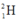 là a:
là a:
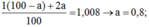

m của 1ml H2O: 1 gam
⇒ MH2O = 2. 1,008 + 16 = 18,016u
Khối lượng của 1 mol H2O là 18,016g.
Khối lượng của 1 mol H2O là 18,016g.
Số mol H2O =  mol
mol
⇒ số mol nguyên tử H = 2.nH2O = 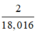 mol
mol
1 mol nguyên tử chứa 6,022.1023 nguyên tử
⇒ Số nguyên tử H trong 1ml H2O = 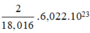
⇒ Số nguyên tử 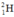 trong 1ml H2O =
trong 1ml H2O = 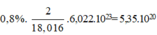 (nguyên tử)
(nguyên tử)

\(Đặt:\%^1H=a\\ \%^2H=100\%-a\\ Vì:\overline{NTK}_H=1,008\\ \Leftrightarrow\dfrac{1.a+2.\left(100\%-a\right)}{100\%}=1,008\\ \Leftrightarrow a=99,2\%\Rightarrow\%^1H=99,2\%;\%^2H=0,8\%\)
Số nguyên tử 2H có trong 1ml nước là:
\(0,8\%.\dfrac{1.1.2}{18}\approx8,889\%\)

Đáp án C
Gọi x là phần trăm nguyên tử của đồng vị H 1 2 ta có:
2 x + 1 ( 1 - x ) = 1 , 008 ⇒ x = 0 , 008
d = 1 g / m l ⇒ m H 2 O = 1 ⇒ n H 2 O = 1 18 ⇒ n H = 1 9 m o l
1 mol H chứa 0,008.6,02.1023 đồng vị H 1 2
⇒ 1 9 mol chứa 0 , 008 . 6 , 02 . 10 23 9 = 5 , 35 . 10 20

Chọn B
Gọi % số nguyên tử của hai đồng vị H 1 và H 2 lần lượt là x và y
Ta có x + y = 100.
Ta lại có:


1 ml có khối lượng là 1 gam. Số mol H2O = 1/18 = 0,056 mol.
H2O ---> 2H + O
Nên số mol H = 2.0,056 = 0,112 mol. Số nguyên tử H là 0,112.6,023.1023 = 674576.1017.
Gọi a, b tương ứng là tỉ lệ % của 11H và 12H.
Ta có: a + 2b = 1,008 và a + b = 1 Suy ra b = 0,008 (0,8%); a = 0,992 (99,2%)
Như vậy, số nguyên tử 11H là 0,992.674576.1017 = 669179392.1014 nguyên tử. Số nguyên tử 12H là 0,008.674576.1017 = 5396608.1014 nguyên tử

\(\%^1H=a;\%^2H=100\%-a\left(a>0\right)\\\overline{NTK}_H=1,008\\ \Leftrightarrow\dfrac{1.a+2.\left(100\%-a\right)}{100\%}=1,008\\ \Leftrightarrow a=99,2\%\\ \Rightarrow^1H=99,2\%;\%^2H=0,8\%\)
Số nguyên tử của đồng vị 2H có trong 9ml nước là:
\(\dfrac{9.1}{18}.6.10^{23}.\dfrac{2}{18}.0,8\%\approx2,667.10^{20}\left(nguyên.tử\right)\)
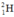
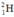
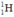

Gọi % đồng vị 21H là a: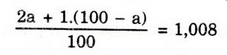
⇒ a = 0,8;
Khối lượng riêng của nước 1 g/ml, vậy 1ml nước có khối lượng 1g. Khối lượng mol phân tử của nước là 18g.