

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án B
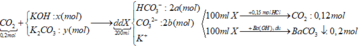
TH1: Nếu trong dd X có OH- dư => dd X chứa OH- dư, CO32-, K+
Khi cho từ từ 100 ml dd X vào 0,15 mol HCl
OH- + H+ → H2O
CO32- + 2H+ → CO2 ↑+ H2O
=> nH+ = nOH- + 2nCO2 > 0,12.2 = 0,24 (mol)
=> loại vì nH+ = 0,15 (mol)
Vậy dd X không chứa OH- dư
TH2: dd X không chứa OH- dư ta có sơ đồ bài toán như trên
Khi cho từ từ 100ml dd X vào 0,15 mol HCl có phản ứng:
HCO3- + H+ → CO2 + H2O
x → x →x (mol)
CO32- + 2H+ → CO2 + H2O
y → 2y → y (mol)

=> a – 3b = 0 (1)
BTNT C: nBaCO3 = a + b = 0,2 (2)
Từ (1) và (2) => a = 0,15 và b = 0,05 (mol)
Trong 200 ml dd X : nHCO3- = 0,3 (mol) ; nCO32- = 0,1 (mol)
Bảo toàn điện tích đối với dd X : nK+ = 0,3 + 0,1.2 = 0,5 (mol)
BTNT C: nCO2(bđ) + nK2CO3 = nHCO3-+ nCO32- => 0,2 + y = 0,3 + 0,1 => y = 0,2 (mol)
BTNT K: nK+ = nKOH + 2nK2CO3 => nKOH = 0,5 – 2.0,2 = 0,1 (mol)
=> x = 0,1 (mol)

Đáp án D
Có n C O 2 b a n đ ầ u = 0,2; n C O 2 s ả n p h ẩ m p h ầ n 1 = 0,12; n B a C O 3 = 0,2
Dung dịch X thu được chứa K2CO3 và KOH dư hoặc K2CO3 và KHCO3
Khi cho 200 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư thu được 0,4 mol kết tủa. Dù thành phần của X gồm những chất nào thì ta luôn có:
n B a C O 3 = n C O 2 b a n đ ầ u + n K 2 C O 3
= 0,2 + y = 0,4 ⇔ y = 0,2
+) Trường hợp 1: Dung dịch X chứa K2CO3 và KOH dư.
Khi đó ở mỗi phần gọi n K 2 C O 3 = a ; n K O H = b
Bảo toàn nguyên tố C, ta có:
2a = n K 2 C O 3 b a n đ ầ u + n C O 2 b a n đ ầ u = 0,4 ⇔ a = 0,2
Khi cho 100ml dung dịch X từ từ vào 300 ml dung dịch HCl 0,5M (0,15 mol HCl) thì xảy ra các phản ứng sau:
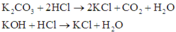
Mà thực tế nHCl < 0,24
Nên trường hợp này không thỏa mãn.
+) Trường hợp 2: Dung dịch X chứa K2CO3 và KHCO3
Khi đó ở mỗi phần gọi n K 2 C O 3 = a ; n K O H = b
Bảo toàn nguyên tố C, ta có:
n B a C O 3 = n K 2 C O 3 + n K H C O 3 = a + b = 0,2 (*)
Khi cho 100ml dung dịch X từ từ vào 300ml dung dịch HCl 0,5M (0,15 mol HCl) thì các phản ứng sau xảy ra đồng thời:
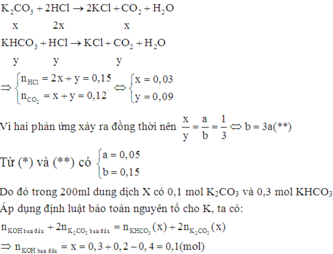

Đáp án B
Do dd M và dd N đều tác dụng với KHSO4 sinh ra kết tủa nên dd M và dd N đều chứa Ba(HCO3)2
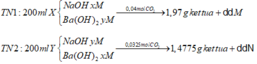


Đáp án B
► Xét TN1: đặt nCO32– phản ứng = a; nHCO3– phản ứng = b.
⇒ nCO2 = a + b = 0,15 mol; nHCl phản ứng = 2a + b = 0,1875 mol
||⇒ giải hệ có: a = 0,0375 mol; b = 0,1125 mol ⇒ nCO32–/X : nHCO3–/X = a : b = 1 : 3.
► Xét TN2: ∑nC/X = n↓ = 0,25 mol ⇒ 250 ml X chứa 0,5 mol C.
Bảo toàn nguyên tố Cacbon: y = 0,5 – 0,25 = 0,25 mol.
● Chia 0,5 mol C thành 0,125 mol CO32– và 0,375 mol HCO3–.
Bảo toàn điện tích: nK+ = 0,625 mol. Bảo toàn nguyên tố Kali:
x = 0,625 – 0,25 × 2 = 0,125 mol

Đáp án A
nOH- = 0,1.2 + 0,225 + 0,2 = 0,625 mol
Do nH+>nCO2 nên X có cả CO32- => X không có Ba2+ => nBaCO3 = 0,1 mol
Đặt x, y là số mol CO32- và số mol HCO3- phản ứng với H+
x+y = nCO2 = 0,25
2x+y = nH+ = 0,35
=> x = 0,1; y = 0,15
Dung dịch X chứa: K+ (0,225 mol), Na+ (0,2 mol), CO32- (0,1k mol), HCO3- (0,15k mol)
BTĐT: 0,225 + 0,2 = 2.0,1k + 0,15k => k = 1,3
BTNT C: nCO2 ban đầu = nBaCO3 + nCO32- + nHCO3- = 0,1 + 0,13 + 0,195 = 0,425 mol
=> V = 9,52 lít

Đáp án D
Khi cho từ từ HCl và X, đã có phương trình tạo khí
H+ + HCO3- → CO2 + H2O
Dung dịch Y không thể chứa OH- , CO32-. Vậy Y chứa KCl 0,5 mol (BTNT cho Cl) và KHCO3 y mol.
Cho y phản ứng với Ba(OH)2 dư:
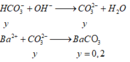
ĐLBKL cho K ta có n(KOH) ban đầu = 0,4x= 0,5 +y = 0,7 => y = 1,75

n H + = 2 n H 2 S O 4 = 0 , 15 . 2 = 0 , 3 ; n S O 4 2 - = 0 , 15 v à n C O 3 2 - = 0 , 1 ; n H C O 3 - = 0 , 3
Xác định tỉ lệ số mol của C O 3 2 - v à H C O 3 - và trong dung dịch ta có:
n N a 2 C O 3 n N a H C O 3 = 0 , 1 0 , 3 = 1 3
So sánh số mol: Ta có: ( 2 n C O 3 2 - + n H C O 3 2 - ) = 0 , 5 > n H + = 0 , 3 ⇒ H + h ế t
Khi cho từ từ A vào B nên C O 3 2 - và H C O 3 - sẽ đồng thời phản ứng với axit.
Vì vậy giả sử nếu C O 3 2 - phản ứng hết x mol thì H C O 3 - sẽ phản ứng 1 lượng đúng bằng tỉ lệ mol trong dung dịch của 2 chất là 3x mol.
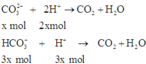
Do H+ hết nên tính theo H+ ta có: 5x = 0,3 ⇒ x = 0,6
⇒ Trong X chứa anion: H C O 3 - (0,3 – 3.0,6 = 0,12 mol), C O 3 2 - (0,1 – 0,06 = 0,04 mol) và S O 4 2 - (0,15 mol)
Khi cho Ba(OH)2 dư vào ta có các phản ứng:
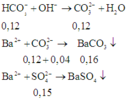
Vậy khối lượng kết tủa thu được là:
![]()