Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
2. Ở thể rắn, NaCl tồn tại dưới dạng tinh thể ion
3. Các chất chỉ có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái
6. Trong phân tử CH4, nguyên tử C có cộng hóa trị 4

Đáp án C
Điện tích hạt nhân X = Số p.(điện tích cơ bản) => số p = 17
=> cấu hình e : 1s22s22p63s23p5 (Clo)
=> Cl- có cấu hình e : 1s22s22p63s23p6
Chỉ có nhận định (3) sai. Cl2 vùa có tính khử , vừa có tính oxi hóa
=>C

Chọn A.
Các công thức cấu tạo của X thoả mãn là CH3-COO-CH2-CH2-CH2-OOC-CH=CH2 ;
CH3-COO-CH(CH3)-CH2-OOC-CH=CH2 và CH=CH2-COO-CH(CH3)-CH2-OOC-CH3.
Các chất Y1: CH2=CHCOOH ; Y2: CH3COOH ; Z: C3H6(OH)2 (2 đồng phân)
B. Sai, Y2 không làm mất màu dung dịch Br2.
C. Sai, Z có 1 đồng phân hòa tan Cu(OH)2 còn 1 đồng phân còn lại không tác dụng.
D. Sai, Chất Y1 không có phản ứng tráng gương.

Đáp án D
X và Y là hai este có cùng số nguyên tử cacbon số nguyên tử C trong X, Y là 0,7 : 0,1 = 7
Este X tham gia phản ứng thủy phân theo tỉ lệ 1:2 và sinh ra nước
X là este của phenolX là C7H6O2 cấu tạo của X là HCOOC6H5.
Số nguyên tử H trung bình của X, Y là 0,3.2:0,1 = 6 Y phải có CTPT là C7H6O4
Y thủy phân tạo ra 3 chất hữu có khác nhau cấu tạo của Y là
HCOO-C=C-C=C OOCCH3 hoặc CH3COO-C → C-OOC-CH=CH2,….
Nhận thấy tùy CTCT của Y có thể có phản ứng tráng gương hoặc không A sai.
X, Y có CTPT khác nhau nên không phải là đồng phân B sai
X là este đơn chức C sai.
Dù với cấu tạo nào thì số liên kết C=C của Y là 3 Y cộng hợp với Br2 theo tỉ lệ 1 : 3D đúng.

Đáp án : D
Hợp chất của Y với H là H2Y => Y thuộc nhóm VIA ( 3s23p4) [ có 2e độc thân ]
Vì phân lớp 3s của X và Y hơn kém nhau 1e => X : 3s1 => X là kim loại kiềm (IA)
[ có 1 e độc thân

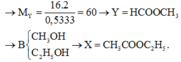


Chọn đáp án B
Dễ thấy X là nguyên tố S còn Y là Clo.
Hai nguyên tố X, Y có số hiệu nguyên tử lần lượt là: 16, 17. Nhận xét nào sau đây Sai?
A. X, Y đều là các nguyên tố phi kim → Đúng
B. Cộng hóa trị của S và Clo trong HCl và H2S lần lượt là II và I → Sai.
C. HClO4 và H2SO4 là axit mạnh → Đúng.
D. Đúng theo SGK lớp 10.