Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. Công thức về khối lượng:
\(m_{Fe_2O_3}+m_{H_2}=m_{Fe}+m_{H_2O}\)
b. Áp dụng câu a, ta có:
\(m_{Fe_2O_3}+2=56+18\)
\(\Leftrightarrow m_{Fe_2O_3}=56+18-2\)
\(\Leftrightarrow m_{Fe_2O_3}=72\left(g\right)\)
\(a)3H_2+Fe_2O_3-^{t^o}\rightarrow2Fe+3H_2O\\b)BTKL:m_{H_2}+m_{Fe_2O_3}=m_{Fe}+m_{H_2O}\\ \Leftrightarrow2+m_{Fe_2O_3}=56+18 \\ \Rightarrow m_{Fe_2O_3}=72\left(g\right)\)

\(a,Fe_2O_3+3H_2\to2Fe+3H_2O\\ b,n_{Fe}=\dfrac{21}{56}=0,375(mol)\\ \Rightarrow n_{Fe_2O_3}=0,1875(mol)\\ \Rightarrow m_{Fe_2O_3}=0,1875.160=30(g)\)

3H2+Fe2O3----->3H2O+2Fe
Ta có
n Fe=11,2/56=0,2(mol)
Theo pthh
n Fe2O3=1/2n Fe=0,1(mol)
m Fe2O3=0,1.160=16(g)
n H2=3/2n Fe=0,15(mol)
V H2=0,15.22,4=3,36(l)

a)\(Fe2O3+3H2-->2Fe+3H2O\)
b)\(n_{H2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{Fe2O3}=\frac{1}{3}n_{H2}=0,1\left(mol\right)\)
\(m_{Fe2O3}=0,1.260=16\left(g\right)\)
c)\(n_{Fe}=\frac{2}{3}nH2=0,2\left(mol\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)

$n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)$
$n_{Fe_2O_3} = \dfrac{40}{160} = 0,25(mol)$
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
$n_{Fe_2O_3} : 1 = 0,25 > n_{H_2} : 3 = 0,1$ nên $Fe_2O_3$ dư
$n_{Fe} = \dfrac{2}{3}n_{H_2} = 0,2(mol)$
$n_{Fe_2O_3\ pư} = \dfrac{1}{3}n_{H_2} = 0,1(mol)$
$n_{Fe_2O_3\ dư} = 0,25 - 0,1 = 0,15(mol)$
Suy ra :
$\%m_{Fe} = \dfrac{0,1.56}{0,1.56 + 0,15.160}.100\% = 18,92\%$

PTHH: \(Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\)
Ta có: \(n_{Fe}=\dfrac{21}{56}=0,375\left(mol\right)\)
\(\Rightarrow n_{Fe_2O_3}=0,1875\left(mol\right)\) \(\Rightarrow m_{Fe_2O_3}=0,1875\cdot160=30\left(g\right)\)

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3
a)\(m_{Fe}=0,3\cdot56=16,8g\)
b)\(Fe_2O_3+3H_2\rightarrow3Fe+3H_2O\)
0,1 0,3 0,3
\(m_{Fe_2O_3}=0,1\cdot160=16g\)
a)nH2 =6,72:22,4=0,3(mol)
PTHH Fe+H2SO4--->FeSO4+H2
theo pt , nFe = nH2 = 0,3 (mol)
=> mFe =n.M=0,3.56=16,8(g)
b) Ta có nH2=nFe=0,3(MOL)
Pthh: Fe2O3 + 3H2 ---> 2Fe + 3H2O
theo pt , nFe2O3=1/3 nH2=0,1(mol)
=> mFe2O3= n.M=0,1.(56.2+16.3)=16(g)
Vậy để có lượng sắt tham gia phản ứng trên phải có 16g Fe2O3 để tác dụng với H2

Câu b là khối lượng của sắt (III) oxit chứ không phải khối lượng của sắt nha em!
Ghi thiếu thôi ạ !![]() chứ nó vẫn tính theo như vậy thưa thầy !
chứ nó vẫn tính theo như vậy thưa thầy !
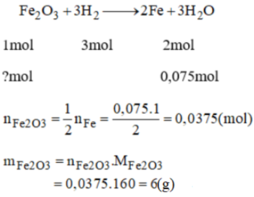
Ta có PTHH: \(3H_2+Fe_2O_3\underrightarrow{t\text{°}}2Fe+3H_2O\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
- Theo PTHH:
+ Để thu được \(\text{2 mol Fe}\) cần đun nóng \(\text{1 mol Fe}_2O_3\)
⇒ Để thu được \(\text{0,1 mol Fe}\) cần đun nóng \(\text{0,05 mol Fe}_2O_3\)
\(m_{Fe_2O_3}=0,05\text{ x }160=8\left(g\right)\)
Vậy:Khối lượng Sắt (III) oxit đã tham gia phản ứng là 8g
============
Chúc bạn học tốt!
.