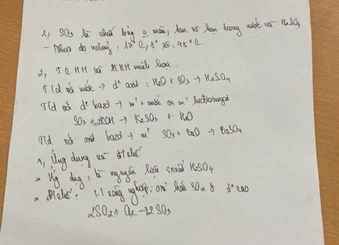Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1 :
\(NaCl+H_2SO_{4\left(đ\right)}\rightarrow NaHSO_4+HCl\)
\(2HCl\underrightarrow{dp}H_2+Cl_2\)
\(H_2S+4Cl_2+4H_2O\rightarrow8HCl+H_2SO_4\)
\(Cu+2H_2SO_{4\left(đ\right)}\rightarrow CuSO_4+SO_2+2H_2O\)
Câu 3:
- Nhiệt phân KMnO4 tạo ra oxi
PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
- Cho tinh thể NaCl vào dd H2SO4 đặc nóng tạo HCl
PTHH: \(2NaCl_{\left(rắn\right)}+H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Na_2SO_4+2HCl\uparrow\)
- Đổ HCl vào MnO2 tạo khí Clo
PTHH: \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2\uparrow+2H_2O\)

Câu 7
a)
Gọi nCu = x
nFe = y
=> 64x + 56y = 18,4 (1)
Bảo toàn e
2x + 3y = 2nSO2 = 2.\(\dfrac{7,84}{22,4}\) = 2.0,35 = 0,7 (2)
Từ (1) + (2) => x = 0,2 , y = 0,1
=> mCu = 0,2 . 64 = 12,8g
%mCu = \(\dfrac{12,8}{18,4}.100\%=69,57\%\)
%mFe = 100 - 69,57 = 30,43%
b) Để hấp thụ hết SO2
=> \(\dfrac{nOH^-}{nSO_2}=1\)
=> nOH- = 0,35mol
=> nNaOH = 0,35 mol
=> Vdd NaOH = 0,35 : 2 = 0,175 lít = 175 ml

Lớp K
- số e tối đa của phân lớp s : 2
- số e tối đa của lớp : 2
- sự phân bố electron trên các phân lớp: 1s2
Lớp L
- số e tối đa của phân lớp s : 2
số e tối đa của phân lớp p : 6
- số e tối đa của lớp : 8
- sự phân bố electron trên các phân lớp: 2s22p6
Lớp M
- số e tối đa của phân lớp s : 2
số e tối đa của phân lớp p : 6
số e tối đa của phân lớp d : 10
- số e tối đa của lớp : 18
- sự phân bố electron trên các phân lớp: 3s23p63d10

nKMnO4 = 14,2/158 ≃ 0,0899 mol
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,0899 \(\dfrac{0,0899\times5}{2}\)
→ nCl2 = 0,22475 mol → VCl2 = 22,4.nCl2 = 5,0344 lít