
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Bài 15 :
Số mol của natri oxit
nNa2O = \(\dfrac{m_{Na2O}}{M_{Na2O}}=\dfrac{15,5}{62}=0,25\left(mol\right)\)
Pt : Na2O + H2O → 2NaOH\(|\)
1 1 2
0,25 0,5
a) Số mol của dung dịch natri hidroxit
nNaOH = \(\dfrac{0,25.2}{1}=0,5\left(mol\right)\)
500ml = 0,5l
Nồng độ mol của dung dịch natri hidroxit thu được
CMNaOH = \(\dfrac{n}{V}=\dfrac{0,5}{0,5}=1\left(M\right)\)
b) H2SO4 + 2NaOH → Na2SO4 + 2H2O\(|\)
1 2 1 1
0,25 0,5
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{0,5.2}{1}=0,25\left(mol\right)\)
Khối lượng của axit sunfuric
mH2SO4 = nH2SO4 . MH2SO4
= 0,25 . 98
= 24,5 (g)
Khối lượng của dung dịch axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{24,5.100}{20}=122,5\) (g)
Thể tích của dung dịch axit sunfuric cần dùng
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{122,5}{1,14}=107,45\left(ml\right)\)
Chúc bạn học tốt

Anh sửa lại chút nha !
\(n_{CO_2}=n_{H_2SO_4}+\dfrac{1}{2}\cdot n_{HCl}=0.4\left(mol\right)\)
\(\Rightarrow n_{HCl}=\left(0.4-0.3\right)\cdot2=0.2\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0.2\cdot2}{0.01}=40\left(M\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.3\cdot2}{0.01}=60\left(M\right)\)
P1 :
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
\(n_{BaSO_4}=n_{H_2SO_4}=\dfrac{6.99}{233}=0.3\left(mol\right)\)
P2 :
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O\)
\(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
\(n_{HCl}=0.4-0.3=0.1\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0.1\cdot2}{0.01}=20\left(M\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.3\cdot2}{0.01}=60\left(M\right)\)

Bài 1:
a) \(n_{CO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
=> nC = 0,25 (mol) => mC = 0,25.12 = 3 (g)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\)
=> nH = 1 (mol) => mH = 1.1 = 1 (g)
Xét mC + mH = 4 (g) => A chứa C, H
b)
Xét nC : nH = 0,25 : 1 = 1 : 4
=> CTPT: (CH4)n
Mà MA = 16 g/mol
=> n = 1
=> CTPT: CH4
Bài 2:
a) \(n_{CO_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
=> nC = 0,5 (mol) => mC = 0,5.12 = 6 (g)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\)
=> nH = 1 (mol) => mH = 1.1 = 1 (g)
=> mO = 15 - 6 - 1 = 8 (g)
b) \(n_O=\dfrac{8}{16}=0,5\left(mol\right)\)
Xét nC : nH : nO = 0,5 : 1 : 0,5 = 1 : 2 : 1
=> CTPT: (CH2O)n
Mà MB = 60 g/mol
=> n = 2
=> CTPT: C2H4O2
Bài 3:
\(n_{CO_2}=\dfrac{3,3}{44}=0,075\left(mol\right)\)
=> nC = 0,075 (mol) => mC = 0,075.12 = 0,9 (g)
\(n_{H_2O}=\dfrac{0,9}{18}=0,05\left(mol\right)\)
=> nH = 0,1 (mol) => mH = 0,1.1 = 0,1 (g)
=> mO = 2,2 - 0,9 - 0,1 = 1,2 (g)
\(n_O=\dfrac{1,2}{16}=0,075\left(mol\right)\)
Xét nC : nH : nO = 0,075 : 0,1 : 0,075 = 3 : 4 : 3
=> CTPT: (C3H4O3)n
Mà M = 44.2 = 88 g/mol
=> n = 1
=> CTPT: C3H4O3
Bạn nên chia nhỏ câu hỏi và chụp góc dễ nhìn đề bài nhé !!!

Bài 2 :
$n_{Ba(OH)_2} = 0,3(mol) ; n_{BaSO_3} = 0,08(mol)$
TH1 : $Ba(OH)_2$ dư
$Ba(OH)_2 + SO_2 \to BaSO_3 + H_2O$
$n_{SO_2} = n_{BaSO_3} = 0,08(mol)$
$V_{SO_2} = 0,08.22,4 = 1,792(lít)$
TH2 : có tạo muối axit
SO2 + Ba(OH)2 → BaSO3 + H2O
0,08......0,08..............0,08..............(mol)
2SO2 + Ba(OH)2 → Ba(HSO3)2
0,44........0,22......................................(mol)
$V_{SO_2} = (0,08 + 0,44).22,4 = 11,648(lít)$
Bài 4 :
$n_{BaCO_3} = 0,05(mol)$
CO2 + Ba(OH)2 → BaCO3 + H2O
0,05......0,05..............0,05..............(mol)
2CO2 + Ba(OH)2 → Ba(HCO3)2
..............0,2..................0,2....................(mol)
Ba(HCO3)2 \(\xrightarrow{t^o}\)BaCO3 + CO2 + H2O
0,2.....................0,2........................(mol)
m = 0,2.197 = 39,4 gam

Câu 1 :
\(1) C_2H_4 + H_2O \xrightarrow{t^o,xt} C_2H_5OH\\ 2) C_2H_5OH + O_2 \xrightarrow{men\ giấm} CH_3COOH + H_2O\\ 3) CH_3COOH + NaOH \to CH_3COONa + H_2O\\ 4) CH_3COOH + C_2H_5OH \buildrel{{H_2SO_4,t^o}}\over\rightleftharpoons CH_3COOC_2H_5 + H_2O\)


\(\text{Giả sử có 1 mol MO: }\\ MO+H_2SO_4 \to MSO_4+H_2O\\ m_{ddH_2SO_4}=\frac{98.100}{20}=490(g)\\ C\%_{MSO_4}=\frac{M+96}{M+16+490}.100\%=22,64\%\\ \to M=24(Mg)\\ \to MgO\)








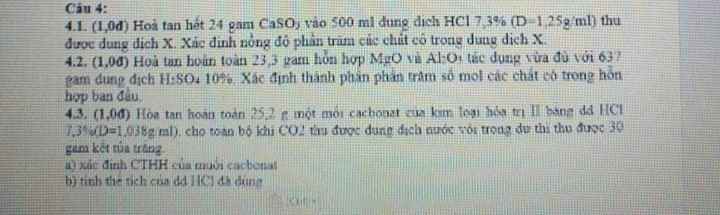
Sửa lại đề 1 chút nhé, có lẽ là bạn ghi nhầm 250ml thành 2500ml
K2O + 2HCl → 2KCl + H2O
FeO + 2HCl → FeCl2 + H2O
\(n_{HCl}=2,5.2=0,5\left(mol\right)\)
Gọi x,y lần lượt là số mol của K2O và FeO
Ta có : \(\left\{{}\begin{matrix}2x+2y=0,5\\94x+72y=20,2\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}x=0,1\\y=0,15\end{matrix}\right.\)
=> \(\%m_{K_2O}=\dfrac{0,1.94}{20,2}.100=46,53\%\)
=> \(\%m_{FeO}=100-46,53=53,47\%\)
b) Ta có : \(n_{KCl}=2n_{K_2O}=0,2\left(mol\right)\)
\(n_{FeCl_2}=n_{FeO}=0,15\left(mol\right)\)
=> \(m_{muoi}=0,2.74,5+0,15.127=33,95\left(g\right)\)
c) \(CM_{KCl}=\dfrac{0,2}{0,25}=0,8M\)
\(CM_{FeCl_2}=\dfrac{0,15}{0,25}=0,6M\)