Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bảo toàn nguyên tố O :
\(n_{H_2O\left(TN1\right)}=n_{H_2O\left(TN2\right)}=0.08\left(mol\right)\)
Ở TN2, Bảo toàn nguyên tố H :
\(n_H=2\cdot n_{H_2O}=2\cdot0.08=0.16\left(mol\right)\)
Với cùng nồng độ mol thì : tỉ lệ số mol giữa HCl và H2SO4 : \(\dfrac{1}{0.5}=\dfrac{2}{1}\)
\(n_{HCl}=2a\left(mol\right),n_{H_2SO_4}=a\left(mol\right)\)
\(\Rightarrow n_H=2a+a\cdot2=0.16\left(mol\right)\)
\(\Rightarrow a=0.04\)
\(m_{Muối}=m_X+m_{HCl}+m_{H_2SO_4}-m_{H_2O}=5+0.08\cdot36.5+0.04\cdot98-0.08\cdot18=10.4\left(g\right)\)





Bài 2 :
$n_{H_2SO_4} =0,52(mol)$
Gọi $n_{CuO} = a(mol) ; n_{MO} = b(mol)$
$\Rightarrow 80a + b(M + 16) = 20,8(1)$
$m_B = 64a + Mb = 18,56(2)$
$Cu + 2H_2SO_4 \to CuSO_4 +S O_2 + 2H_2O$
$M + 2H_2SO_4 \to MSO_4 + SO_2 + 2H_2O$
Theo PTHH : $2a + 2b = 0,52(3)$
Từ (1)(2)(3) suy ra vô nghiệm
Chứng tỏ oxit MO không bị khử bởi hidro
$m_B = 64a + b(M + 16) = 18,56(4)$
$MO + H_2SO_4 \to MSO_4 + H_2O$
$n_{H_2SO_4} = 2a + b = 0,52(5)$
Từ (1)(4)(5) suy ra a = 0,14 ; Mb = 5,76 ; b = 0,24
$\Rightarrow M = \dfrac{5,76}{0,24} = 24(Magie)$
b)
Cho hỗn hợp vào dung dịch NaOH lấy dư, lọc tách dung dịch :
- dung dịch : $NaOH,NaAlO_2$
- chất rắn : $CuO,MgO$
$2NaOH + 2Al + 2H_2O \to 2NaAlO_2 + 3H_2$
+) Sục $CO_2$ tới dư vào phần dung dịch, thu lấy kết tủa rồi nung ở nhiệt độ cao thì thu được $Al_2O_3$
$NaOH + CO_2 \to NaHCO_3$
$NaAlO_2 + 2H_2O + CO_2 \to Al(OH)_3 + NaHCO_3$
$2Al(OH)_3 \xrightarrow{t^o} Al_2O_3 + 3H_2O$
Nung phần chất rắn trong khí hidro ở nhiệt độ cao :
$CuO + H_2 \xrightarrow{t^o} Cu + H_2O$
Cho hỗn hợp chất rắn sau khi nung vào dung dịch HCl, lọc tách dung dịch :
- dung dịch : $MgCl_2$
- chất rắn : $Cu$
+) Nung chất rắn trong khí oxi lấy dư, thu được CuO$
$2Cu +O_2 \xrightarrow{t^o} 2CuO$
+) Cho phần dung dịch vào dung dịch NaOH lấy dư, thu lấy kết tủa nung ở nhiệt độ cao :
$MgCl_2 + 2NaOH \to Mg(OH)_2 + 2NaCl$
$Mg(OH)_2 \xrightarrow{t^o} MgO + H_2O$


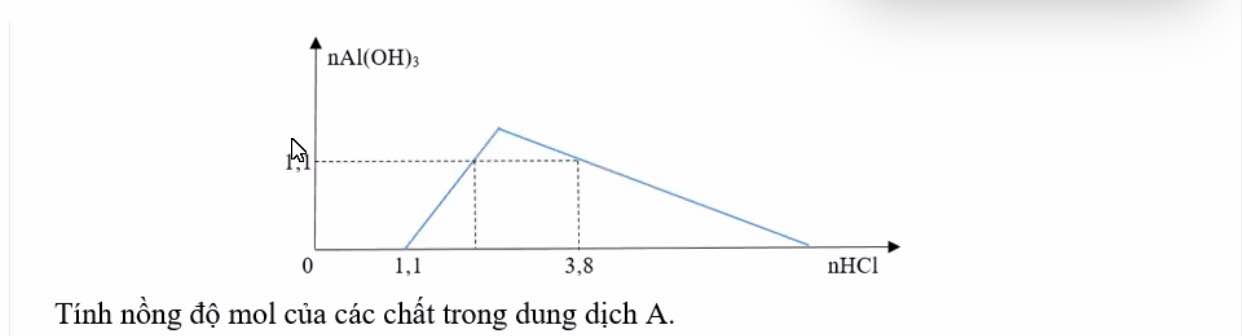
a) Ban đầu không hiện tượng sau một thời gian thu được kết tủa keo trắng rồi tan
$NaOH + HCl \to NaCl + H_2O$
$NaAlO_2 + HCl + H_2O \to NaCl + Al(OH)_3$
$Al(OH)_3 + 3HCl \to AlCl_3 + 3H_2O$
b)
$n_{NaOH} = 1,1(mol)$
Ta có :
$n_{HCl} = 4n_{NaAlO_2} - n_{Al(OH)_3} + n_{NaOH}$
$\Rightarrow 3,8 = 4n_{NaAlO_2} - 1,1 + 1,1$
$\Rightarrow n_{NaAlO_2} = 0,95(mol)$
Vậy :
$C_{M_{NaOH}} = \dfrac{1,1}{0,5} = 2,2M$
$C_{M_{NaAlO_2}} = \dfrac{0,95}{0,5}= 1,9M$
a) Ban đầu:
HCl + NaOH ---------> NaCl + H2O
NaAlO2 + HCl + H2O → Al(OH)3↓ + NaCl.
Sau đó, Al(OH)3 ↓ + 3HCl → AlCl3 + 3H2O

\(a.n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.0,1........0,2..........0,1.........0,1\left(mol\right)\\ C\%_{ddH_2SO_4}=\dfrac{0,1.98}{140}.100=7\%\\ c.m_{dd.muối}=6,5+140-0,1.2=146,3\left(g\right)\\ C\%_{ddZnCl_2}=\dfrac{136.0,1}{146,3}.100\approx9,296\%\\ \)
a.nZn=6,565=0,1(mol)Zn+2HCl→ZnCl2+H2b.0,1........0,2..........0,1.........0,1(mol)C%ddH2SO4=0,1.98140.100=7%c.mdd.muối=6,5+140−0,1.2=146,3(g)C%ddZnCl2=136.0,1146,3.100≈9,296%