
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 32: \(CH_4+2O_2\xrightarrow[]{t^o}CO_2+2H_2O\)
\(0,25\) \(\rightarrow0,25mol\)
\(V_{CO_2}=0,25.22,4=5,6\left(l\right)\)
Chọn A
Câu 34:
\(C_2H_4+3O_2\rightarrow2H_2O+2CO_2\)
\(n_{C_2H_4}=\dfrac{14}{28}=0,5\left(mol\right)\)
Theo PT ta có:
\(n_{CO_2}=2n_{C_2H_4}=2.0,5=1\left(mol\right)\)
\(\Rightarrow m_{CO_2}=1.44=44\left(g\right)\)
Chọn A
Câu 38: Thể tích tối đa của khí CO2 thu được ở đktc là:
\(n_{CO_2}=\dfrac{m}{M}=\dfrac{1,2}{12}=0,1\left(mol\right)\)
\(V_{CO_2}=22,4.0,1=2,24\left(l\right)\)
Chọn D

Bài 15 :
Số mol của natri oxit
nNa2O = \(\dfrac{m_{Na2O}}{M_{Na2O}}=\dfrac{15,5}{62}=0,25\left(mol\right)\)
Pt : Na2O + H2O → 2NaOH\(|\)
1 1 2
0,25 0,5
a) Số mol của dung dịch natri hidroxit
nNaOH = \(\dfrac{0,25.2}{1}=0,5\left(mol\right)\)
500ml = 0,5l
Nồng độ mol của dung dịch natri hidroxit thu được
CMNaOH = \(\dfrac{n}{V}=\dfrac{0,5}{0,5}=1\left(M\right)\)
b) H2SO4 + 2NaOH → Na2SO4 + 2H2O\(|\)
1 2 1 1
0,25 0,5
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{0,5.2}{1}=0,25\left(mol\right)\)
Khối lượng của axit sunfuric
mH2SO4 = nH2SO4 . MH2SO4
= 0,25 . 98
= 24,5 (g)
Khối lượng của dung dịch axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{24,5.100}{20}=122,5\) (g)
Thể tích của dung dịch axit sunfuric cần dùng
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{122,5}{1,14}=107,45\left(ml\right)\)
Chúc bạn học tốt

Ta có: nNaOH=20/40=0,5(mol)
nCO2=22/44=0,5(mol)
Ta có: 0,5/0,5=1
=> Chỉ tạo một muối axit duy nhất NaHCO3.
PTHH: NaOH + CO2 -> NaHCO3
Ta có: nNaHCO3=nNaOH=0,5(mol)
=>mNaHCO3=0,5. 84=42(g)
\(n_{NaOH}=\dfrac{20}{40}=0,5\left(mol\right)\\ n_{CO_2}=\dfrac{22}{44}=0,5\left(mol\right)\)
Có \(\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,5}{0,5}=\dfrac{1}{1}\)
\(\Rightarrow\) Phản ứng tạo muối axit.
PTHH \(NaOH+CO_2\rightarrow NaHCO_3\)
\(n_{NaHCO_3}=n_{NaOH}=0,5\left(mol\right)\)
\(m_{NaHCO_3}=0,5\cdot84=42\left(g\right)\)

Anh sửa lại chút nha !
\(n_{CO_2}=n_{H_2SO_4}+\dfrac{1}{2}\cdot n_{HCl}=0.4\left(mol\right)\)
\(\Rightarrow n_{HCl}=\left(0.4-0.3\right)\cdot2=0.2\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0.2\cdot2}{0.01}=40\left(M\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.3\cdot2}{0.01}=60\left(M\right)\)
P1 :
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
\(n_{BaSO_4}=n_{H_2SO_4}=\dfrac{6.99}{233}=0.3\left(mol\right)\)
P2 :
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O\)
\(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
\(n_{HCl}=0.4-0.3=0.1\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0.1\cdot2}{0.01}=20\left(M\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.3\cdot2}{0.01}=60\left(M\right)\)

C5:
nC2H5OH = 8,2 / 46 = 0,2 (mol)
C2H5OH + 3O2-- (t^o)-- > 2CO2 + 3H2O
VCO2 = 0,4 . 22,4 = 8,96 (l)
VO2 = 0,6.22,4=13,44 (l)


a) $KOH,Ba(OH)_2$
b)
$2Al(OH)_3 + 3H_2SO_4 \to Al_2(SO_4)_3 + 6H_2O$
$Fe(OH)_2 + H_2SO_4 \to FeSO_4 + 2H_2O$
$2Fe(OH)_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 6H_2O$
$2KOH + H_2SO_4 \to K_2SO_4+ 2H_2O$
$Cu(OH)_2 + H_2SO_4 \to CuSO_4 + 2H_2O$
$Ba(OH)_2 + H_2SO_4 \to BaSO_4 + 2H_2O$
c)
$2KOH + SO_2 \to K_2SO_3 + H_2O$
$Ba(OH)_2 + SO_2 \to BaSO_3 + H_2O$
d)
$CuSO_4 + 2KOH \to Cu(OH)_2 + K_2SO_4$
$CuSO_4 + Ba(OH)_2 \to BaSO_4 + Cu(OH)_2$
e)
$2Al(OH)_3 \xrightarrow{t^o} Al_2O_3 + 3H_2O$
$Fe(OH)_2 \xrightarrow{t^o} FeO + H_2O$
$2Fe(OH)_3 \xrightarrow{t^o} Fe_2O_3 + 3H_2O$
$Cu(OH)_2 \xrightarrow{t^o} CuO + H_2O$
Bài 4:
\(a.\)
Chất làm quỳ tím hóa xanh : KOH , Ba(OH)2
\(b.\)
\(2Al\left(OH\right)_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
\(Fe\left(OH\right)_2+H_2SO_4\rightarrow FeSO_4+2H_2O\)
\(2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(KOH+H_2SO_4\rightarrow K_2SO_4+H_2O\)
\(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
\(c.\)
\(2KOH+SO_2\rightarrow K_2SO_3+H_2O\)
\(Ba\left(OH\right)_2+SO_2\rightarrow BaSO_3+H_2O\)
\(d.\)
\(2KOH+CuSO_4\rightarrow Cu\left(OH\right)_2+K_2SO_4\)
\(Ba\left(OH\right)_2+CuSO_4\rightarrow BaSO_4+Cu\left(OH\right)_2\)
\(e.\)
\(2Al\left(OH\right)_3\underrightarrow{^{^{t^0}}}Al_2O_3+3H_2O\)
\(2Fe\left(OH\right)_3\underrightarrow{^{^{t^0}}}Fe_2O_3+3H_2O\)
\(4Fe\left(OH\right)_2+O_2\underrightarrow{^{^{t^0}}}2Fe_2O_3+4H_2O\)
\(Cu\left(OH\right)_2\underrightarrow{^{^{t^0}}}CuO+H_2O\)

a) Đặt CT là \(Na^I_xO^{II}_y\left(x,y:nguyên,dương\right)\)
Theo quy tắc hóa trị, ta có:
\(I.x=II.y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{II}{I}=\dfrac{2}{1}\\ \Rightarrow x=2;y=1\)
=> CTHH cần tìm Na2O
b)
Đặt CT là \(C^{IV}_xS^{II}_y\left(x,y:nguyên,dương\right)\)
Theo quy tắc hóa trị, ta có:
\(IV.x=II.y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{II}{IV}=\dfrac{2}{4}=\dfrac{1}{2}\\ \Rightarrow x=1;y=2\)
=> CTHH cần tìm là CS2
c)
Đặt CT là \(Ca^{II}_x\left(NO_3\right)^I_y\left(x,y:nguyên,dương\right)\)
Theo quy tắc hóa trị, ta có:
\(II.x=I.y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{I}{II}=\dfrac{1}{2}\\ \Rightarrow x=1;y=2\)
-> CTHH là Ca(NO3)2
d)
Đặt CT là \(Ba^{II}_x\left(SO_4\right)^{II}_y\left(x,y:nguyên,dương\right)\)
Theo quy tắc hóa trị, ta có:
\(II.x=II.y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{II}{II}=\dfrac{2}{2}=\dfrac{1}{1}\\ \Rightarrow x=1;y=1\)
=> CTHH cần tìm là BaSO4










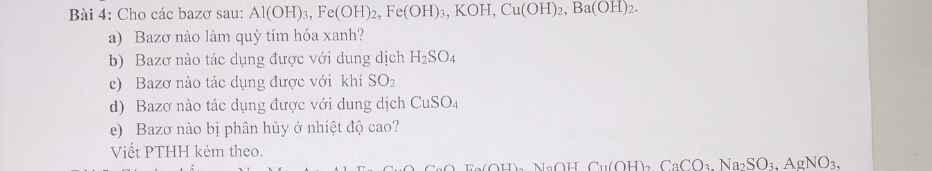

Bài 42 :
\(n_{H_2SO_4}=n_{H_2O}=0.4\cdot2=0.8\left(mol\right)\)
Bảo toàn khối lượng :
\(a=44.8+0.8\cdot98-0.8\cdot18=108.8\left(g\right)\)
\(n_{H_2O}=\dfrac{1}{2}\cdot n_{HCl}=\dfrac{1}{2}\cdot0.4=0.2\left(mol\right)\)
Bảo toàn khối lượng :
\(m=24.1+0.2\cdot18-0.4\cdot36.5=13.1\left(g\right)\)