
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.





MFe2O3=56×2+16×3=160(g/mol)MFe2O3=56×2+16×3=160(g/mol)
%mFe=56×2160.100%=70%%mFe=56×2160.100%=70%
MFe3O4=56×3+16×4=232(g/mol)MFe3O4=56×3+16×4=232(g/mol)
%mFe=56×3232.100%≈72,4%

PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Coi mKClO3 = mKMnO4 = 1 (g)
Ta có: \(n_{KClO_3}=\dfrac{1}{122,5}\left(mol\right)\) \(\Rightarrow n_{O_2\left(KClO_3\right)}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{245}\left(mol\right)\)
\(n_{KMnO_4}=\dfrac{1}{158}\left(mol\right)\Rightarrow n_{O_2\left(KMnO_4\right)}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{316}\left(mol\right)\)
\(\Rightarrow\dfrac{3}{245}>\dfrac{1}{316}\)
Vậy: Cùng 1 khối lượng, KClO3 cho nhiều khí O2 hơn.
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
Qua phương trình trên ta thấy đc KClO3 thu đc nhiều khí oxi hơn là KMnO4


Bài 6 :
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,1 0,1 0,1
a) \(n_{H2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,1.22,4=2,24\left(l\right)\)
b) \(n_{FeCl2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{FeCl2}=0,1.127=12,7\left(g\right)\)
Chúc bạn học tốt

\(\dfrac{2A}{2A+16.5}=\dfrac{43,66}{100}\)
=> \(200A=43,66.\left(2A+16.5\right)\)
=> \(200A-87,32A=3492,8\)
=> \(112,68A=3492,8\)
=> A= 31
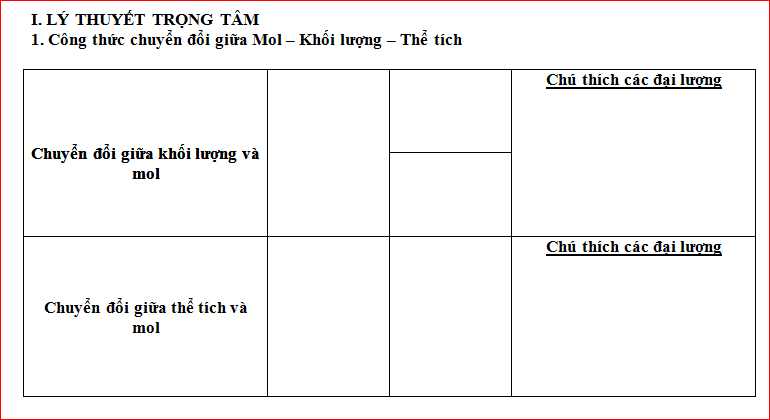





Chuyển đổi giữa khối lượng và mol
\(n=\dfrac{m}{M}\\ m=n\cdot M\\ M=\dfrac{m}{n}\)
Trong đó:
\(n:\) số mol
\(m:\) khối lượng (gam)
\(M:\) khối lượng mol (g/mol)
Chuyển đổi giữa thể tích và mol (đối với chất khí ở điều kiện chuẩn)
\(n=\dfrac{V}{22,4}\\ V=n\cdot22,4\)
Trong đó:
\(n:\) Số mol
\(V:\) Thể tích chất khí ( l)