Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
HCl → H++ Cl-
[H+] = a M ; suy pH = -log a = x
![]()
Cứ 100 phân tử CH3COOH thì có 1 phân tử điện li nên [H+] = a/100 M suy ra pH = -log (a/100) = y
Do đó y-x = 2

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
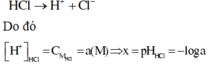
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
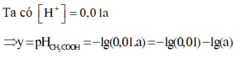
![]()
Đáp án A.

Chọn đáp án D
Đây là 2 dung dịch có môi trường bazo.NaOH có tính bazo mạnh hơn nên x >y.

Đáp án A
Theo bài ra : X tác dụng với NaOH theo tỉ lệ mol 1 : 3 tạo ra 2 muối (trong đó có 1 muối có M < 100) và 1andehit no đơn chức mạch hở
=> X có dạng HCOO-C6H4-COOCH=CH2
HCOO-C6H4-COOCH=CH2 + 3NaOH -> CH3CHO + NaO-C6H4-COONa + HCOONa + H2O
1 mol 1 mol 1 mol
HCOONa có M = 68 < 100
Ta có : CH3CHO -> 2Ag
HCOONa -> 2Ag
=> nAg = 4 mol => m = 432g


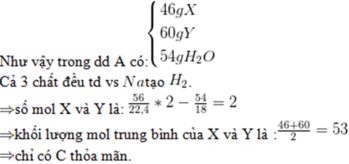
Đáp án D
Cứ 100 phân tử CH3COOH thì có 1 phân tử phân li
⇒ nH+/HCl = 100nH+/ CH3COOH
Mà dung dịch HCl và CH3COOH có cùng nồng độ
⇒ [H+/HCl] = 100[H+/ CH3COOH]
⇒ -log[H+/HCl] = -2 - log[H+/ CH3COOH]
⇒ x = -2 + y ⇒ y = x + 2
Đáp án D.