Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
VA/VB = (1-0,1)/(1+0,1) = 9/11

Đáp án : D
Trong A :
n H + = 2 n H 2 S O 4 + n H N O 3 + n H C l = 0,21 mol
Trong B :
n O H - = nNaOH + nKOH = 0,49V mol
Để C có pH = 2 (axit) => H+ dư
=> nH+(C) = 10-pH .(0,3 + V) = 0,21 – 0,49V
=> V = 0,414 lit

Đáp án : B
Trong X :
n H + = 2 n H 2 S O 4 + n H C l + n H N O 3 = 0,21 mol
Trong Y : nOH = nNaOH + 2 n B a O H 2 = 0,4V mol
Vì dung dịch sau trộn có pH = 1 < 7 => axit dư
=> n H + Z = (V + 0,3).10-pH= 0,21 – 0,4V
=> V = 0,36 lit

Chọn A
450 ml X do trộn 225 ml HCl và 225 ml H2SO4 => nH+ = 0,1125 mol
nOH = 0,2V (mol)
Do Z có pH = 1 (axit) => axit dư => nH+ dư = 10-pH.(0,45 + V) = 0,1125 – 0,2V
=> V = 0,225 lit

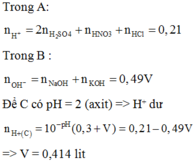


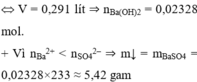

Chọn B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được: