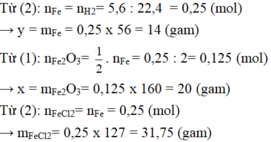Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b) \(n_{H_2SO_4}=C_MV=1,2\cdot0,5=0,6\left(mol\right)\)
PTHH : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,6 0,6 0,6
\(\Rightarrow m_{FeSO_4}=n_{FeSO_4}M_{FeSO_4}=0,6\cdot152=91,2\left(g\right)\)
c) Từ câu b \(\Rightarrow n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow V_{H_2}=n_{H_2}.22,4=0,6\cdot22,4=13,44\left(l\right)\)
d) PTHH : \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,6 0,6
\(\Rightarrow m_{Cu}=n_{Cu}M_{Cu}=0,6\cdot64=38,4\left(g\right)\)
a)\(PTHH:Fe+H_2SO_4\xrightarrow[]{}FeSO_4+H_2\)
b)Đổi 500ml = 0,5l
Số mol của H2SO4 là:
\(C_{MH_2SO_4}=\dfrac{n_{H_2SO_4}}{V_{H_2SO_{\text{4 }}}}\Rightarrow n_{H_2SO_4}=C_{MH_2SO_4}.V_{H_2SO_4}=1,2.0,5=0,6\left(mol\right)\)
\(PTHH:Fe+H_2SO_4\xrightarrow[]{}FeSO_4+H_2\)
Tỉ lệ : 1 1 1 1 (mol)
Số mol : 0,6 0,6 0,6 0,6(mol)
Khối lượng sắt(II)sunfat thu được là:
\(m_{FeSO_4}=n_{FeSO_4}.M_{FeSO_{\text{4 }}}=0,6.152=91,2\left(g\right)\)
c) Thể tích khí H2 thoát ra là:
\(V_{H_2}=n_{H_2}.22,4=0,6.22,4=13,44\left(l\right)\)
d)\(PTHH:CuO+H_2\xrightarrow[]{t^0}Cu+H_2O\)
tỉ lệ :1 1 1 1 (mol)
số mol :0,6 0,6 0,6 0,6 (mol)
Khối lượng CuO điều chế được là:
\(m_{CuO}=n_{CuO}.M_{CuO}=0,6.80=48\left(g\right)\)

a) Fe + H2SO4 --> FeSO4 + H2
b)
\(n_{H_2SO_4}=0,3.0,6=0,18\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,18<--0,18---->0,18-->0,18
=> \(m_{FeSO_4}=0,18.152=27,36\left(g\right)\)
c) VH2 = 0,18.22,4 = 4,032 (l)

Sửa đề : 11.2 g sắt
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.2....0.2.................0.2\)
\(m_{FeSO_4}=0.2\cdot152=30.4\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.2}{0.05}=4\left(M\right)\)

a) \(Pt:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b) \(n_{Fe}=\dfrac{0,56}{56}=0,01mol\)
Theo pt: \(n_{FeSO_4}=n_{Fe}=0,01mol\)
\(\Rightarrow m_{FeSO_4}=0,01.152=1,52g\)
Theo pt: \(n_{H_2}=n_{Fe}=0,01mol\)
\(\Rightarrow V_{H_2}=0,01.22,4=0,224lít\)
c) \(Theopt:nH_2SO_4=n_{Fe}=0,01mol\)
\(\Rightarrow m_{H_2SO_4}=0,01.98=0,98g\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,98.100}{19,6}=5g\)

`a)PTHH:`
`Fe + 2HCl -> FeCl_2 + H_2`
`0,4` `0,4` `0,4`
`n_[H_2] = [ 8,96 ] / [ 22,4 ] = 0,4 (mol)`
`b) m_[Fe] = 0,4 . 56 = 22,4 (g)`
`c) m_[FeCl_2] = 0,4 . 127 = 50,8 (g)`

`a)PTHH:`
`Fe + 2HCl -> FeCl_2 + H_2`
`0,3` `0,6` `0,3` `0,3` `(mol)`
`n_[Fe]=[22,4]/56=0,4(mol)`
`n_[HCl]=0,3.2=0,6(mol)`
Ta có:`[0,4]/1 > [0,6]/2`
`=>Fe` dư
`b)m_[FeCl_2]=0,3.127=38,1(g)`
`c)m_[Fe(dư)]=(0,4-0,3).56=5,6(g)`
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(n_{HCl}=0,3.2=0,6\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Xét: \(\dfrac{0,4}{1}>\dfrac{0,6}{2}\) ( mol )
0,3 0,6 0,3 ( mol )
\(m_{FeCl_2}=0,3.127=38,1\left(g\right)\)
\(m_{Fe\left(dư\right)}=\left(0,4-0,3\right).56=5,6\left(g\right)\)

Mình thay trên câu a luôn nhé.
5. Số mol của Fe là :
nFe = 5,6/56 = 0,1 (mol)
a) Ta có PTHH :
Fe + 2HCl \(\rightarrow\) FeCl2 + H2\(\uparrow\)
1 mol 2 mol 1 mol 1 mol
0,1 mol 0,2 mol 0,1 mol 0,1 mol
Số mol của Fe là :
nFe = 5,6/56 = 0,1 (mol)
b) Khối lượng của FeCl2 tạo thành sau p.ứng là :
mFeCl2 = 0,1.127 = 12,7 (g)
c) Thể tích khí Hiđro (đktc) tạo thành sau p.ứng là :
VH2 = 0,1.22,4 = 2,24 (l)
4. Công thức của B là : NaxCyOz
+ \(m_{Na}=\frac{106.43,6}{100}\approx46\left(g\right)\)
\(m_C=\frac{106.11,3}{100}\approx12\left(g\right)\)
\(m_O=\frac{106.45,3}{100}\approx48\left(g\right)\)
+ \(n_{Na}=\frac{46}{23}=2\left(mol\right)\)
\(n_C=\frac{12}{12}=1\left(mol\right)\)
\(n_O=\frac{48}{16}=3\left(mol\right)\)
Suy ra trong một p.tử h/c có 2 n.tử Na, 1 n.tử C và 3 n.tử O.
\(\Rightarrow\) CTHH của hợp chất B là Na2CO3.