

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

- Xét phần 1: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Na}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
\(2Na+2HCl\rightarrow2NaCl+H_2\)
a---------------------------->0,5a
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
b----------------------------->b
`=> 0,5a + b = 0,05 (1)`
- Xét phần 2: Đặt hệ số tỉ lệ \(\dfrac{P_2}{P_1}=k\left(k>0\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Na}=ak\left(mol\right)\\n_{Mg}=bk\left(mol\right)\end{matrix}\right.\)
Ta có: \(m_{gi\text{ả}m}=m_{O\left(CuO\right)\left(p\text{ư}\right)}=8-6,72=1,28\left(g\right)\)
\(\Rightarrow n_{CuO\left(p\text{ư}\right)}=n_{O\left(p\text{ư}\right)}=\dfrac{1,28}{16}=0,08\left(mol\right)\)
PTHH:
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
ak-------------------------->0,5ak
\(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
0,08-->0,08
`=> 0,5ak = 0,08 <=> ak = 0,16 (2)`
- Xét hỗn hợp ban đầu:
Ta có: \(\dfrac{hhb\text{đ}}{P_1}=\dfrac{P_1+P_2}{P_1}=\dfrac{P_1+k.P_1}{P_1}=k+1\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Na}=a\left(k+1\right)\left(mol\right)\\n_{Mg}=b\left(k+1\right)\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow23a\left(k+1\right)+24b\left(k+1\right)=8,2\left(3\right)\)
Từ \(\left(1\right),\left(2\right),\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,04\\b=0,03\\k=4\end{matrix}\right.\left(TM\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Na}=\dfrac{0,04.23}{0,04.23+0,03.24}.100\%=56,1\%\\\%m_{Mg}=100\%-56,1\%=43,9\%\end{matrix}\right.\)

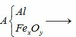
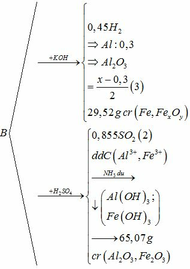
Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)
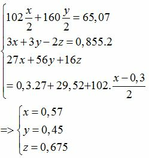
=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb
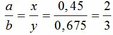
=> Fe2O3

P1: Gọi số mol CO, H2 trong phần 1 là a, b mol
PTHH: CuO + CO --to--> Cu + CO2
CuO + H2 --to--> Cu + H2O
\(n_{Cu}=\dfrac{4,48}{64}=0,07\left(mol\right)\)
=> a + b = 0,07 (1)
P2: Gọi số mol CO, H2 trong phần 2 là ak, bk mol
=> 28ak + 2bk - 28a - 2b = 1,32 (2)
\(n_{CaCO_3}=\dfrac{6}{100}=0,06\left(mol\right)\)
PTHH: CO + O2 --to--> CO2
CO2 + Ca(OH)2 --> CaCO3 + H2O
=> ak = 0,06 (mol) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,02\\b=0,05\\k=3\end{matrix}\right.\)
=> m = (0,02.28 + 0,05.2) + (0,06.28+0,15.2) = 2,64(g)
\(\left\{{}\begin{matrix}\%CO=\dfrac{0,02}{0,07}.100\%=28,57\%\\\%H_2=\dfrac{0,05}{0,07}.100\%=71,43\%\end{matrix}\right.\)