Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Do sản phẩm thu được sau khi nung khi hòa tan vào dd HCl thu được hỗn hợp khí => Sản phẩm chứa Fe dư
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\); \(n_S=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PTHH: Fe + S --to--> FeS
0,05<-0,05-->0,05
Fe + 2HCl --> FeCl2 + H2
0,05-->0,1---------->0,05
FeS + 2HCl --> FeCl2 + H2S
0,05-->0,1------------->0,05
=> \(\%V_{H_2}=\%V_{H_2S}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\)
b)
nNaOH = 0,2.1 = 0,2 (mol)
PTHH: NaOH + HCl --> NaCl + H2O
0,2-->0,2
=> nHCl = 0,1 + 0,1 + 0,2 = 0,4 (mol)
=> \(C_{M\left(dd.HCl\right)}=\dfrac{0,4}{0,5}=0,8M\)

Gọi n Fe = a (mol )
n Mg = b (mol ) (a,b > 0)
--> 56a+24b = 13,2
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a 2a a a
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
b 2b b b
----> a+b=0,35
Ta có hệ Pt :
\(\left\{{}\begin{matrix}56a+24b=13,2\\a+b=0,35\end{matrix}\right.\)
Giải hệ PT , ta có :
a= 0,15
b = 0,2 (mol )
\(V_{HClđủ}=\left(0,15.2+0,2.2\right):0,5=1,4\left(l\right)\)
\(a,m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)
\(\%m_{Fe}=\dfrac{8,4}{13,2}.100\%\approx63,64\%\)
\(\%m_{Mg}=\dfrac{4,8}{13,2}.100\%\approx36,36\%\)
\(b,m_{FeCl_2}=0,15.127=19,05\left(g\right)\)
\(m_{MgCl_2}=0,2.95=19\left(g\right)\)
\(c,HCl+NaOH\rightarrow NaCl+H_2O\)
0,2 0,2
\(m_{NaOH}=\dfrac{100.8}{100}=8\left(g\right)\)
\(n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
\(V_{HCldư}=\dfrac{n}{C_M}=\dfrac{0,2}{0,5}=0,4\left(l\right)\)
\(V_{HCl}=V_{HClđủ}+V_{HCldư}=1,4+0,4=1,8\left(l\right)\)

Có lẽ đề yêu cầu tính nồng độ mol các chất trong dung dịch sau pư bạn nhỉ?
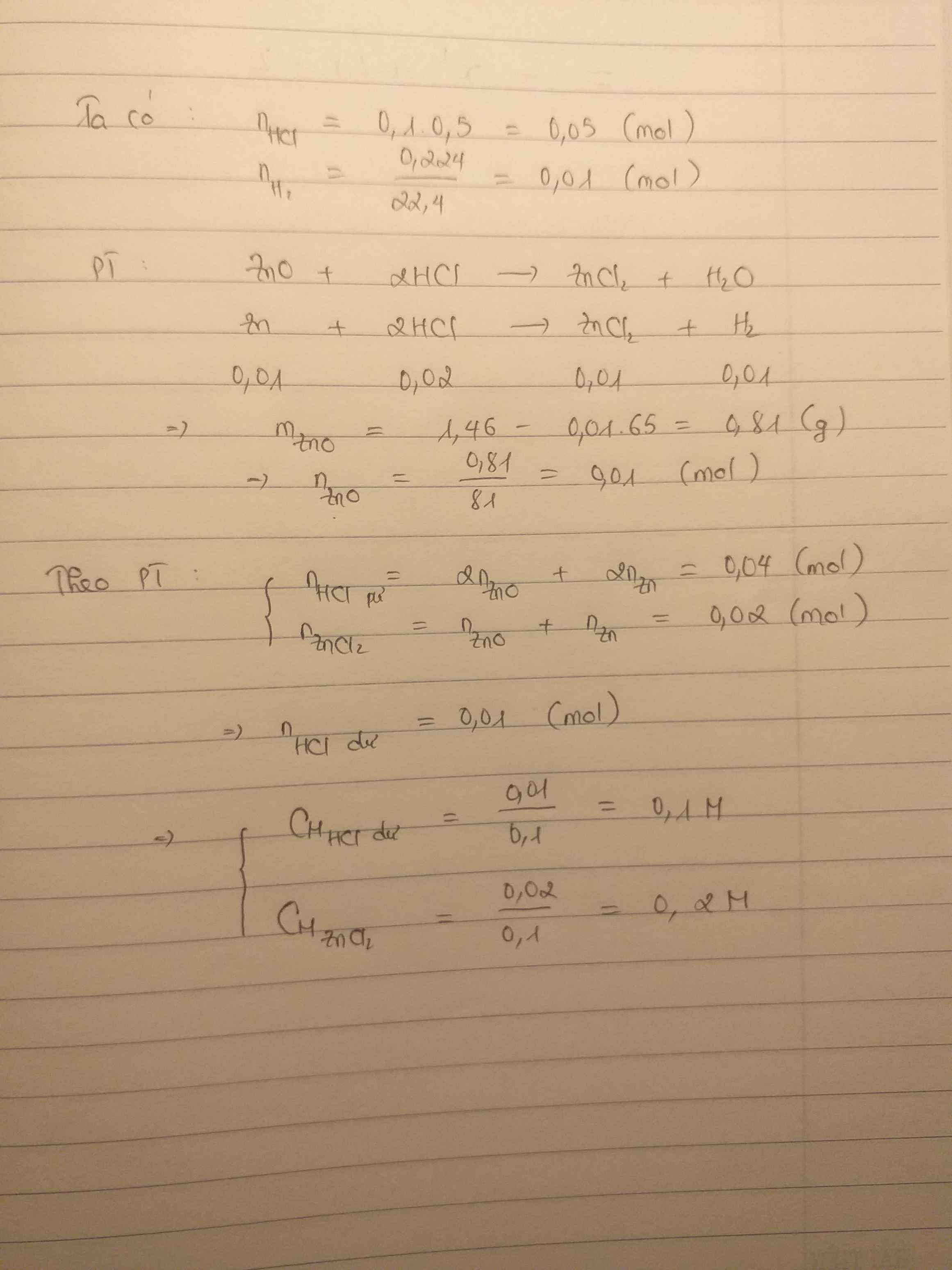
PTHH: ZnO + 2HCl -> ZnCl\(2 \) + H\(2 \)O
Zn + 2HCl -> ZnCl\(2 \) + H\(2 \)
nH2= V/22.4= 0.224/22.4=0.01 mol
Mà nZn=nH2 => nZn=0.01 mol
mZn=n.M= 0.01 x 65 = 0,65g
mZnO= 1.46-0.65=0.81g => nZnO= m/M= 0.81/81=0.01 mol
nddHCl=V.CM=0.1 x 0.5= 0.05 mol
Theo pt ta thấy: nHCl= 0.01 x 2 + 2x0.01= 0.04 mol
nHCl dư= 0.05-0.04=0.01 mol
=> CM HCl dư= 0.01/0.1= 0.1M
CM ZnCl2= 0.01+0.01/0.1=0.2M

a)Gọi x,y lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu (x,y>0)
Sau phản ứng hỗn hợp muối khan gồm: \(\left\{{}\begin{matrix}AlCl_3:x\left(mol\right)\\FeCl_2:y\left(mol\right)\end{matrix}\right.\)
Ta có hệ phương trình: \(\left\{{}\begin{matrix}27x+56y=13,9\\133,5x+127y=38\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x\approx0,0896\\y\approx0,205\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,0896\cdot27\cdot100\%}{13,9}\approx17,4\%\\\%m_{Fe}=\dfrac{0,205\cdot56\cdot100\%}{13,9}\approx82,6\%\end{matrix}\right.\)
Theo Bảo toàn nguyên tố Cl, H ta có:\(n_{H_2}=\dfrac{n_{HCl}}{2}=\dfrac{3n_{AlCl_3}+2n_{FeCl_2}}{2}\\ =\dfrac{3\cdot0,0896+2\cdot0,205}{2}=0,3394mol\\ \Rightarrow V_{H_2}=0,3394\cdot22,4\approx7,6l\)

\(n_{Na}=\dfrac{6.9}{23}=0.3\left(mol\right)\)
\(n_S=\dfrac{3.84}{32}=0.12\left(mol\right)\)
\(2Na+S\underrightarrow{^{^{t^0}}}Na_2S\)
Lập tỉ lệ : \(\dfrac{0.3}{2}>\dfrac{0.12}{1}\Rightarrow Nadư\)
A gồm : Na2S , Na
\(m_{Na\left(dư\right)}=\left(0.3-0.12\cdot2\right)\cdot23=1.38\left(g\right)\)
\(m_{Na_2S}=0.12\cdot78=9.36\left(g\right)\)
\(b.\)
\(Na+HCl\rightarrow NaCl+\dfrac{1}{2}H_2\)
\(Na_2S+2HCl\rightarrow2NaCl+H_2S\)
\(V=0.03\cdot22.4+0.12\cdot22.4=3.36\left(l\right)\)
a)
$n_{Na} = \dfrac{6,9}{23} = 0,3(mol)$
$n_S = \dfrac{3,84}{32} = 0,12(mol)$
$2Na + S \xrightarrow{t^o} Na_2S$
$n_{Na} : 2 = 0,15 > n_S : 1$ do đó Na dư.
$n_{Na_2S} =n_S = 0,12(mol)$
$n_{Na\ dư} = 0,3 - 0,12.2 = 0,06(mol)$
$m_{Na_2S} = 0,12.78 = 9,36(gam)$
$m_{Na\ dư} = 0,06.23 = 1,38(gam)$
b)
$2Na + 2HCl \to 2NaCl + H_2$
$Na_2S + 2HCl \to 2NaCl + H_2S$
$n_{H_2} = \dfrac{1}{2}n_{Na\ dư} = 0,03(mol)$
$n_{H_2S} = n_{Na_2S} = 0,12(mol)$
$V_{H_2} = (0,03 + 0,12).22,4 = 3,36(lít)$
a, PT: \(Fe+S\underrightarrow{t^o}FeS\)
Ta có: \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,1}{1}\), ta được Fe dư.
Chất rắn A gồm Fe dư và FeS.
Theo PT: \(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,1\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,2\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2}=n_{Fe\left(dư\right)}=0,2\left(mol\right)\\n_{H_2S}=n_{FeS}=0,1\left(mol\right)\end{matrix}\right.\)
Ở cùng điều kiện nhiệt độ và áp suất, %V cũng là % số mol.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,2}{0,2+0,1}.100\%\approx66,67\%\\\%V_{H_2S}\approx33,33\%\end{matrix}\right.\)
b, Ta có: \(\Sigma n_{HCl\left(dadung\right)}=2n_{Fe}+2n_{FeS}=0,6\left(mol\right)\) (1)
PT: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(n_{NaOH}=0,1.2=0,2\left(mol\right)\)
\(\Rightarrow n_{HCl\left(dư\right)}=n_{NaOH}=0,2\left(mol\right)\) (2)
Từ (1) và (2) \(\Rightarrow\Sigma n_{HCl}=0,8\left(mol\right)\)
\(\Rightarrow C_{M_{ddHCl}}=\dfrac{0,8}{0,5}=1,6\left(M\right)\)
Bạn tham khảo nhé!