Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)6KMnO4--->3K2MnO4 + 3MnO2 + 3O2 (1)
2KClO3---> 2KCl + 3O2 (2)
Dựa vào phương trình trên ---> thu cùng lượng O2, KMnO4 cần nhiều số mol hơn, và khối lượng nhiều hơn.
b)6KClO3-->6KCl + 9O2 (3)
1,3--->Cùng số mol, KClO3 cho nhiều O2 hơn.
c)Giả sử cả 2 chất cùng có khối lượng là 100g
nKMnO4=50/79(mol)
nKClO3=40/49
Thay vào các phương trình phản ứng tính ra mO2
Cụ thể: KMnO4 cho ra 800/79 (g) O2
KClO3 cho ra 1920/49 (g) O2
---> Cùng m thì KClO3 cho nhiều g O2 hơn.
d) Giả sử cần điều chế 32 g O2
--->nO2=1 mol
--->nKMnO4=2 mol--->mKMnO4=316g
và nKClO3=2/3 mol--->nKClO3=245/3g
Ta có:
-1000g KMnO4 <=> 200000đ
316 g=========>63200đ
-1000g KClO3 <=> 300000đ
245/3g========> 24500đ
Vậy để điều chế cùng lượng O2, KClO3 có giá thành rẻ hơn.

\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
\(\dfrac{m}{122,5}\) \(\dfrac{3m}{245}\) ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
\(\dfrac{m}{158}\) \(\dfrac{m}{316}\) ( mol )
So sánh:
\(\dfrac{3m}{245}\) > \(\dfrac{m}{316}\)
=> \(KClO_3\) cho nhiều O2 hơn

\(Đặt:\)
\(m_{ddđầu}=a\left(g\right)\)
\(\Rightarrow m_{ct}=0.15a\left(g\right)\)
Trong x có 0,15a gam chất tan
Sau khi bay hơi 60g nước, còn lại a - 60 gam dd.
\(C\%=18\%\)
\(\Rightarrow\dfrac{0.15a}{a-60}\cdot100\%=18\%\)
\(\Rightarrow a-60=\dfrac{5}{6}a\)
\(\Rightarrow a=360\left(g\right)\)

$a)2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2$
$b) n_{KClO_3} = \dfrac{73,5}{122,5} = 0,6(mol)$
$n_{KCl} = n_{KClO_3} = 0,6(mol)$
$m_{KCl} = 0,6.74,5 = 44,7(gam)$
$c) n_{O_2} = \dfrac{3}{2}n_{KClO_3} = 0,9(mol)$
$V_{O_2} = 0,9.22,4 = 20,16(lít)$

\(Coi\ n_{O_2} = 1(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 2(mol) \\ m_{KMnO_4} = 2.158 =316(gam)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = \dfrac{2}{3}(mol)\\ m_{KClO_3} = \dfrac{2}{3}.122,5 = 81,6(gam)\\ \Rightarrow m_{KMnO_4} > m_{KClO_3}(316<81,6)\)

Giả sử cần điều chế 3,36lit O 2 tương đương với 0,15 mol O 2
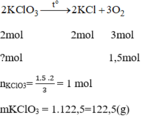
Số tiền mua 122,5g để điều chế 1,5mol O 2 :
0,1225.96000 = 11760 (đồng)
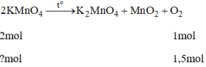
n K M n O 4 = 1,5 . 2 =3 mol
n K M n O 4 = 3.158 = 474 (g)
Số tiền mua 474g để điều chế 1,5 mol O 2 :
0,474.30000 = 14220(đồng)
Vậy để điều chế cùng 1 thể tích khí O 2 thì dùng K C l O 3 để điều chế kinh tế hơn mặc dù giá tiền cao mua 1 kg K C l O 3 cao hơn nhưng thể tích khí O 2 sinh ra nhiều hơn.

Gọi \(\left\{{}\begin{matrix}n_{KClO_3}=a\left(mol\right)\\n_{KMnO_4}=b\left(mol\right)\end{matrix}\right.\)
nO = 3a + 4b (mol)
nK = a + b (mol)
nCl = a (mol)
nMn = b (mol)
Do số nguyên tử O chiếm 5/8 số nguyên tử trong A
=> \(n_O=\dfrac{5}{8}\left(n_O+n_K+n_{Cl}+n_{Mn}\right)\)
=> \(3n_O=5.n_K+5.n_{Cl}+5.n_{Mn}\)
=> 3(3a + 4b) = 5(a + b) + 5a + 5b
=> a - 2b = 0 (1)
PTHH: 2KClO3 --to--> 2KCl + 3O2
a----------------->1,5a
2KMnO4 --to--> K2MnO4 + MnO2 + O2
b-------------------------------->0,5b
=> \(1,5a+0,5b=\dfrac{15,68}{22,4}=0,7\) (2)
(1)(2) => a = 0,4; b = 0,2
m = 0,4.122,5 + 0,2.158 = 80,6 (g)
=> \(\left\{{}\begin{matrix}\%m_{KClO_3}=\dfrac{0,4.122,5}{80,6}.100\%=60,8\%\\\%m_{KMnO_4}=\dfrac{0,2.158}{80,6}.100\%=39,2\%\end{matrix}\right.\)

\(2KMnO_4\underrightarrow{^{t^0}}K_2MnO_4+MnO_2+O_2\)
\(\dfrac{a}{158}.............................\dfrac{a}{79}\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(\dfrac{a}{122.5}............\dfrac{3a}{245}\)
\(TC:\)
\(\dfrac{a}{79}>\dfrac{3a}{245}\)
=> Lượng Cl2 điều chế từ KMnO4 lớn nhất.

Z gồm CO2 và O2 dư
$C + O_2 \xrightarrow{t^o} CO_2$
$n_{CO_2} =n_{O_2\ pư} = n_C = \dfrac{1,128}{12} = 0,094(mol)$
Gọi $n_{O_2} = 2a \to n_{không\ khí} = 3a(mol)$
Trong Y :
$n_{O_2} = 2a + 3a.20\% = 2,6a(mol)$
$n_{N_2} = 3a.80\% = 2,4a(mol)$
Trong Z :
$n_{CO_2} = 0,094(mol)$
$n_{N_2} = 2,4a(mol)$
$n_{O_2\ dư} = n_{O_2} - n_{O_2\ pư} = 2,6a - 0,094(mol)$
m CO2 =0,094.44 = 4,136(gam)
=> m Z = 4,136 : 27,5% = 15,04(gam)
SUy ra :
4,136 + 2,4a.28 + (2,6a - 0,094).32 = 15,04
=> a = 0,0925
=> n O2 = 0,0925.2 = 0,185(mol)
m X = 43,5 : 46,4% = 93,75(gam)
Bảo toàn khối lượng : m = 93,75 + 0,185.32 = 99,67(gam)

PTHH: 2KMnO4 →to→ 2KMnO2+MnO2 +O2
2KClO3 →to→ 2KCl +3O2
Ta có:
+nKMnO4= \(\dfrac{1000}{39+55+16.4}\approx6,32\left(mol\right)\)
⇒nO2 ≈3,16(mol)
+VO2 = 3,16 . 22,4 ≈70,784(lit)
Mặt khác ta thấy:
+nKClO3=\(\dfrac{1000}{39+35,5+16.3}\approx8,16\left(mol\right)\)
⇒nO2≈12,14(mol)
+VO2= 12,14 . 22,4 ≈271,936(lit)
Vậy 1kg KClO3 sinh ra nhiều hơn 1kg KMnO4
Không chắc lắm đâu @@
cảm ơn bạn nha <3 dễ thương quá ^^