Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Xét phân tử hydrogen: mỗi nguyên tử hydrogen có 2 electron lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Helium
- Xét phân tử Oxygen: mỗi nguyên tử Oxygen có 8 electron ở lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Neon

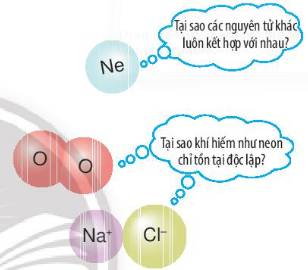
Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron) là lớp vỏ bền vững. Vì vậy, các nguyên tử khí hiếm tồn tại độc lập trong điều kiện thường.

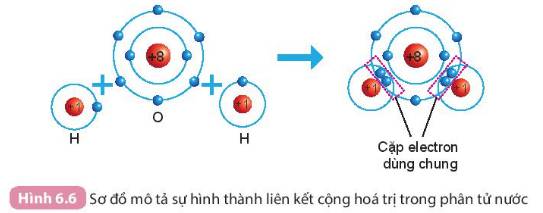
Nguyên tử `O` liên kết với nguyên tử `H` theo cách dùng chung electron, vỏ nguyên tử lớp oxygen giống lớp vỏ của nguyên tử khí hiếm `Ne`.

Đều có 8e lơp ngoài cùng
Riêng heli thì chỉ có 2e lnc
ngoại trừ He, các nguyên tố khí hiếm còn lại đều có số e lớp ngoài cùng là 8

- Số electron dùng chung của nguyên tử H và O là 4
- Trong phân tử nước:
+ Nguyên tử O có 8 electron lớp ngoài cùng => Giống khí hiếm Ne
+ Nguyên tử H có 2 electron lớp ngoài cùng => Giống khí hiếm He

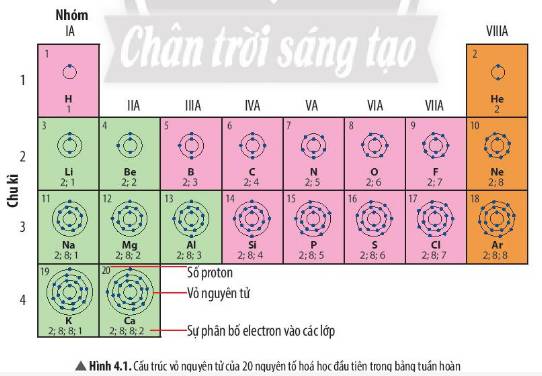
- Vị trí kim loại: nằm ở phía bên trái và góc dưới bên phải của bảng tuần hoàn
- Vị trí phi kim: nằm ở phía trên, bên phải của bảng tuần hoàn
- Vị trí khí hiếm: tất cả các nguyên tố nằm trong nhóm VIIIA

Các nguyên tử của nguyên tố có xu hướng kết hợp với nhau để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm.
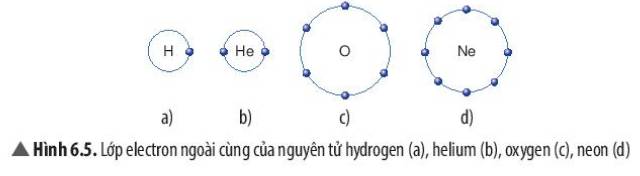



- Hydrogen gần với nguyên tố khí hiếm Helium
- H có 1 electron lớp ngoài cùng, He có 2 electron lớp ngoài cùng
=> Nguyên tử hydrogen có xu hướng nhận thêm 1 electron để đạt cấu hình của Helium
- Oxygen gần với nguyên tố khí hiếm Neon
- H có 6 electron lớp ngoài cùng, Ne có 8 electron lớp ngoài cùng
=> Nguyên tử Oxygen có xu hướng nhận thêm 2 electron để đạt cấu hình của Neon