Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Zn}=\dfrac{16.25}{65}=0.25\left(mol\right)\)
\(n_{Cl_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(Zn+Cl_2\underrightarrow{^{t^0}}ZnCl_2\)
\(0.15...0.15.....0.15\)
\(Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\)
\(0.25-0.15..................................0.2\)
\(ZnCl_2+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2AgCl\)
\(0.15..................................................0.3\)
\(m_{AgCl}=0.3\cdot143.5=43.05\left(g\right)\)
\(m_{Ag}=0.2\cdot108=21.6\left(g\right)\)
\(m\downarrow=43.05+21.6=64.65\left(\right)\)
=> D

Có lẽ đề cho nung kết tủa trong không khí chứ không phải "để" bạn nhỉ?
PT: \(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
____0,04_____0,04_____0,04 (mol)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
0,03_____0,03______0,03 (mol)
⇒ nCuSO4 dư = 0,1 - 0,04 - 0,03 = 0,03 (mol)
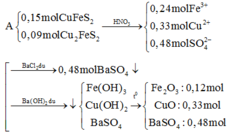
- Dung dịch X gồm: ZnSO4: 0,04 (mol), FeSO4: 0,03 (mol) và CuSO4: 0,03 (mol)
PT: \(ZnSO_4+Ba\left(OH\right)_2\rightarrow Zn\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
______0,04__________________0,04______0,04 (mol)
\(Zn\left(OH\right)_2+Ba\left(OH\right)_2\rightarrow BaZnO_2+2H_2O\)
\(FeSO_4+Ba\left(OH\right)_2\rightarrow Fe\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
0,03____________________0,03______0,03 (mol)
\(CuSO_4+Ba\left(OH\right)_2\rightarrow Cu\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
0,03____________________0,03_______0,03 (mol)
- Kết tủa thu được gồm: Fe(OH)2: 0,03 (mol), Cu(OH)2: 0,03 (mol) và BaSO4: 0,1 (mol)
PT: \(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
_________0,03_________0,015 (mol)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
0,03_________0,03 (mol)
⇒ m = mFe2O3 + mCuO + mBaSO4 = 0,015.160 + 0,03.80 + 0,1.233 = 28,1 (g)

Phản ứng:
KClO3 + 6HCl →→ KCl + 3Cl2 ↑ + 3H2O.
![]() 0,1 0,3
0,1 0,3
Sau đó:
118,5gam kết tủa dạng nguyên tố gồm 0,6mol Cl và còn lại là 0,9mol Ag.
Theo đó, số mol AgNO3 là 0,9. Muối (M; NO3) biết khối lượng M là 16,8gam và số mol NO3 là 0,9
→ Lập tỉ lệ 16,8\0,9=56\3 → cho biết kim loại M là Fe



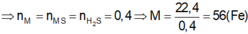
\(Zn + Cl_2 \xrightarrow{t^o} ZnCl_2\\ n_{Zn} = \dfrac{13}{65} = 0,2 > n_{Cl_2} = 0,15\). Do đó.Zn dư
Zn + Cl2 \(\xrightarrow{t^o}\) ZnCl2
0,15.......0,15....0,15......................(mol)
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
0,05........................................... 0,1..........(mol)
ZnCl2 + 2AgNO3 → 2AgCl + Zn(NO3)2
0,15...............................0,3.........................(mol)
Vậy :
\(m_{kết\ tủa} = 0,1.108 + 0,3.143,5 = 53,85(gam)\)
\(n_{Zn}=\dfrac{13}{65}=0.2\left(mol\right)\)
\(Zn+Cl_2\underrightarrow{t^0}ZnCl_2\)
\(0.15....0.15...0.15\)
\(\Rightarrow Zndư,Cl_2hết\)
\(ZnCl_2+2AgNO3\rightarrow Zn\left(NO_3\right)_2+2AgCl\)
\(0.15..................................................0.3\)
\(m_{AgCl}=0.3\cdot143.5=430.05\left(g\right)\)
Chúc bạn học tốt !!!