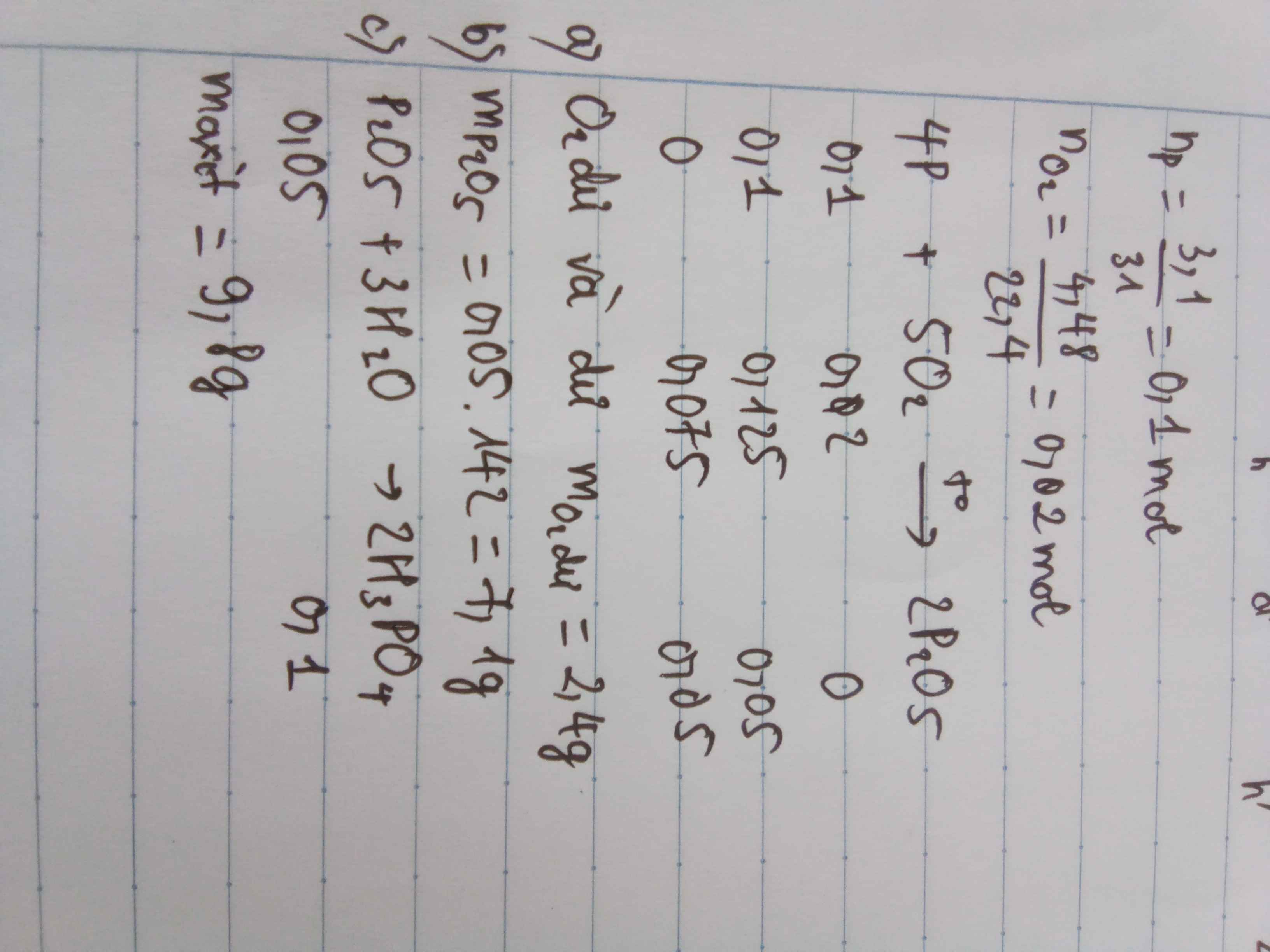Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
\(4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\)
b)
Ta có :
\(n_{P_2O_5} = \dfrac{7,1}{142} = 0,05\ mol\\ \Rightarrow n_P = 2n_{P_2O_5} = 0,05.2 = 0,1(mol)\\ \Rightarrow m_P = 0,1.31 = 3,1(gam)\)
c)
\(n_{O_2} = \dfrac{5}{4} n_P = 0,125(mol)\\ V_{O_2} = 0,125.22,4 = 2,8(lít)\)
Giả sử Oxi chiếm 20% thể tích không khí.
\(V_{không\ khí} = \dfrac{2,8}{20\%} = 14(lít)\)

\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(BTKL:m_{Fe}+m_{O_2}=m_{Fe_3O_4}\)
\(\Leftrightarrow m_{Fe_3O_4}=8.4+\dfrac{4.48}{22.4}\cdot32=14.8\left(g\right)\)
a) \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b)\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Lập tỉ lệ ta có : \(\dfrac{n_{Fe}}{3}< \dfrac{n_{O_2}}{2}\)
=> Sau phản ứng O2 dư, Fe phản ứng hết
Chất rắn sau phản ứng là Fe3O4
\(n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=0,05\left(mol\right)\)
=> mFe3O4=0,05.232=11,6g

a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{4}< \dfrac{0,4}{5}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=0,25\left(mol\right)\Rightarrow n_{O_2\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,15.32=4,8\left(g\right)\)
c, Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,1\left(mol\right)\Rightarrow m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
d, \(m_{P_2O_5}=14,2.80\%=11,36\left(g\right)\)

a) P cháy sáng , có khí trắng bám bình
4P+5O2-to>2P2O5
0,2----0,25------0,1 mol
n P=\(\dfrac{7,44}{31}\)=0,24 mol
n O2=\(\dfrac{8}{32}\)=0,25 mol
P dư :
=>m cr=0,1.142+0,04.31=15,44g
a, Phản ứng sáng chói, P cháy trong O2 tạo ra chất rắn màu trắng dạng bột là P2O5
\(b,n_P=\dfrac{7,44}{31}=0,24\left(mol\right)\\ n_{O_2}=\dfrac{8}{32}=0,25\left(mol\right)\\ PTHH:4P+5O_2\underrightarrow{t^o}2P_2O_5\\ LTL:\dfrac{0,24}{4}>\dfrac{0,25}{5}\Rightarrow P.dư\\ Theo.pt:n_{P_2O_5}=\dfrac{2}{5}n_{O_2}=\dfrac{2}{5}.0,25=0,1\left(mol\right)\\ m_{P_2O_5}=0,1.142=14,2\left(g\right)\\ Theo.pt:n_{P\left(pư\right)}=\dfrac{4}{5}n_{O_2}=\dfrac{4}{5}.0,25=0,2\left(mol\right)\\ m_{P\left(dư\right)}=\left(0,24-0,2\right).31=1,24\left(g\right)\\ m_X=1,24+14,2=15,44\left(g\right)\)

- Cho phản ứng xảy ra hoàn toàn (2 chất trong A có sắt và oxit khác oxit sắt ban đầu)
\(yH_2+Fe_xO_y\rightarrow\left(t^o\right)xFe+yH_2O\left(1\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\left(2\right)\\ n_{H_2\left(2\right)}=n_{Fe\left(2\right)}=n_{Fe\left(1\right)}=0,3\left(mol\right)\\ n_{O\left(trong.oxit\right)}=n_{H_2O}=n_{H_2}=0,4\left(mol\right)\\ BTKL:m_{H_2}+m_{oxit}=m_A+m_{H_2O}\\ \Leftrightarrow0,4.2+m=28,4+18.0,4\\ \Leftrightarrow m=34,8\left(g\right)\\ b,x:y=0,3:0,4=3:4\Rightarrow x=3;y=4\\ \Rightarrow CTHH:Fe_3O_4\)

\(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2mol\)
4P + 5O2 \(\underrightarrow{t^o}\) 2P2O5
\(\dfrac{0,1}{4}< \dfrac{0,2}{5}\) => O2 dư, Photpho đủ
\(n_{O_2}=0,2-0,04=0,16\left(mol\right)\)
\(m_{P_2O_5}=\) 0,05 . 142 = 7,1 ( g )

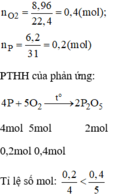
→ Oxi dư, vậy bài toán tính theo số mol của P
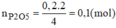
Do H = 80% nên khối lượng chất rắn thu được sau phản ứng là:

Bài 2: (chị Hương Giang làm cho bạn bài 1 rồi)
Áp dụng ĐLBTKL, ta có:
mM + mO2 = mM2On
=> mO2 = 4 - 2,4 = 1,6 (g)
nO2 = 1,6/32 = 0,05 (mol)
PTHH: 4M + nO2 -> (to) 2M2On
Mol: 0,2/n <--- 0,05
M(M) = 2,4/(0,2/n) = 12n (g/mol)
Xét:
n = 1 => Loại
n = 2 => M = 24 => Mg
n = 3 => Loại
Vạya M là Mg