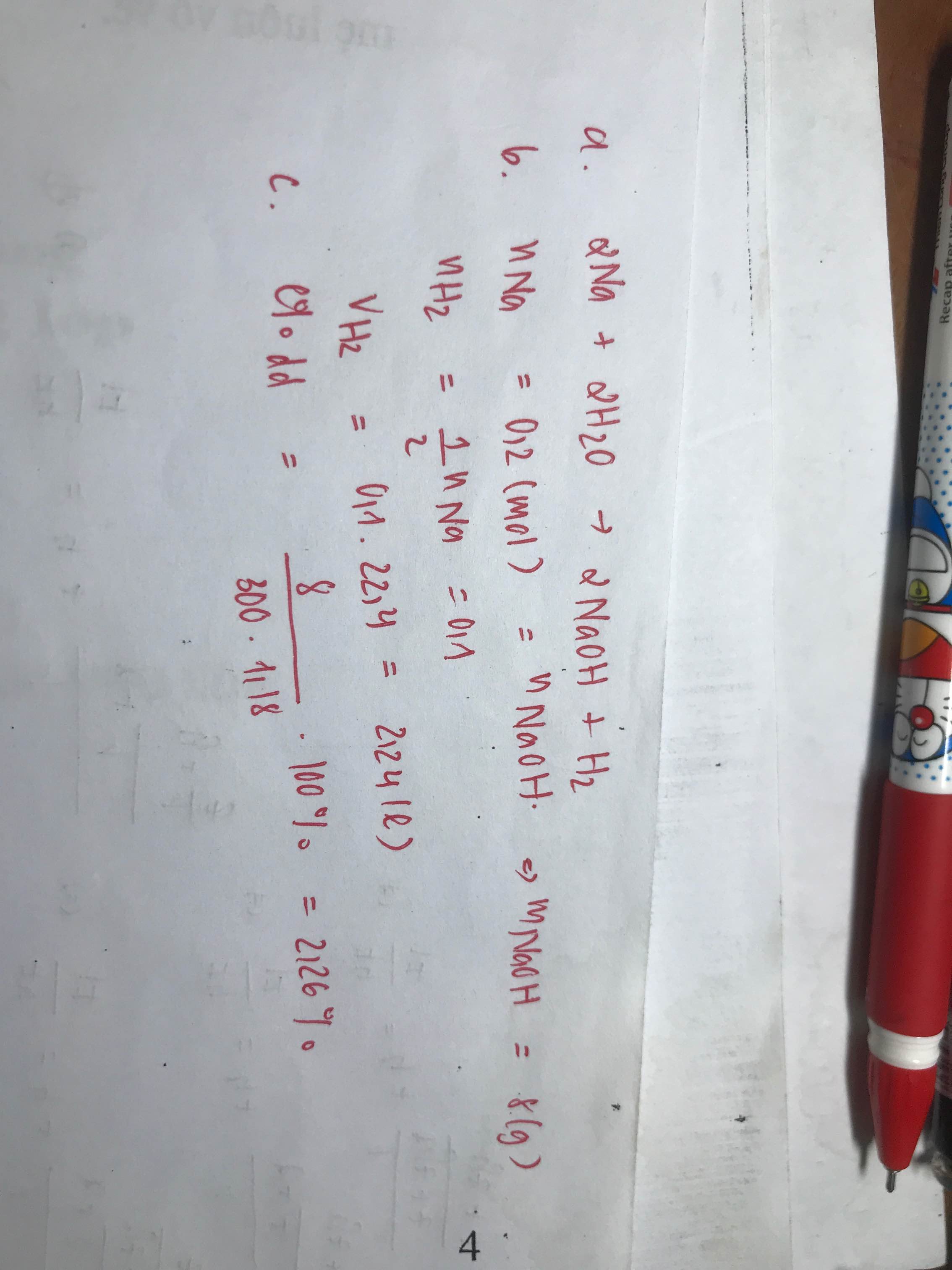Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nNa = 4,6 / 23 = 0,2 (mol)
Na + 2H2O -- > NaOH + H2
mH2 = 0,2.2 =0,4 (g)
dd = mNa + mddH2O - mH2 = 4,6 + 200 - 0,4 = 204,2(g)
mNaOH = 0,2 . 40 = 8(g)
=> \(C\%_{ddA}=\dfrac{8.100}{204,2}=3,9\%\)

\(n_{Na}=\dfrac{4,6}{23}=0,2mol\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,2 0,2 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{NaOH}=0,2\cdot40=8g\)
\(m_{ddNaOH}=4,6+0,2\cdot18-0,1\cdot2=8g\)
\(\Rightarrow C\%=\dfrac{m_{NaOH}}{m_{ddNaOH}}\cdot100\%=\dfrac{8}{8}\cdot100\%=100\%???\)
Sửa đề: Tính nồng độ mol của dung dịch NaOH???
\(C_{M_{NaOH}}=\dfrac{0,2}{0,3}=\dfrac{2}{3}M\)

Đốt cháy hoàn toàn 4,6g Natri rồi lấy sản phẩm cho vào 120g dd NaOH 25% thu được dd X. Tính C% dd X
--
nNa= 0,2(mol)
mNaOH= 120.25%= 30(g) -> nNaOH= 0,75(mol)
PTHH: Na + H2O -> NaOH +1/2 H2 (1)
nNaOH (1)= nNa= 0,2(mol)
=> nNaOH= 0,2+0,75=0,95(mol)
mNaOH= 0,95.40= 38(g)
mddNaOH(sau)= 120+4,6-0,1.2= 124,4(g)
=> \(C\%ddNaOH\left(sau\right)=\frac{38}{124,4}.100\approx30,547\%\)

Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a, PT: \(4Na+O_2\underrightarrow{t^o}2Na_2O\)
______0,8___0,2___0,4 (mol)
b, a = mNa = 0,8.23 = 18,4 (g)
c, mNaOH = 0,4.40 = 16 (g)
\(\Rightarrow C\%_{NaOH}=\dfrac{16}{150}.100\%\approx10,67\%\)
Bạn tham khảo nhé!

Bài 1: PTHH: Na2O + H2O → 2NaOH
Số mol của Na2O là: 12,4 : 62 = 0,2 mol
100 gam nước tương ứng với 100 ml nước = 0,1 lít
a) Số mol của NaOH là: 0,2 . 2 = 0,4 mol
Khối lượng chất tan NaOH là: 0,4 . 40 = 16 gam
Áp dụng định luật bảo toàn khối lượng để tính khối lượng dung dịch NaOH sau phản ứng là: 112,4 gam
C% dd sau pứ là: (16 : 112,4 ) . 100% = 14,235%
b) CM của dung dịch sau phản ứng là:
0,4 : 0,1 = 4M

Trong dd ban đầu:
K+_____a mol
Mg2+___b mol
Na+____c mol
Cl-_____a + 2b + c mol
mhhbđ = 74.5a + 95b + 58.5c = 24.625 g______(1)
nAgNO3 = 0.3*1.5 = 0.45 mol
Cho Mg vào A có phản ứng (theo gt) nên Ag(+) còn dư, Cl(-) hết. Rắn C gồm Ag và có thể cả Mg còn dư nữa. Thật vậy, khi cho rắn C vào HCl loãng thì khối lượng rắn bị giảm đi, chính do Mg pư, Ag thì không. Vậy mrắn C giảm = mMg chưa pư với A = 1.92 g.
=> nMg dư = 1.92/24 = 0.08 mol
=> nMg pư với A = 2.4/24 - 0.08 = 0.02 mol________(*)
Khi cho Mg vào A có pư:
Mg + 2Ag(+) ---> 2Ag(r) + Mg(2+)
0.02__0.04
=> nAg(+) pư với dd ban đầu = 0.45 - 0.04 = 0.41 mol
Ag(+) + Cl(-) ---> AgCl(r)
0.41___0.41
Có: nCl(-) = a + 2b + c = 0.41_____________(2)
Trong các cation trên, Mg(2+) và Ag(+) có pư với OH(-), tuy nhiên trong D chỉ có Mg(2+) nên kết tủa là Mg(OH)2:
Mg(2+) + 2OH(-) ---> Mg(OH)2
Khi nung:
Mg(OH)2 ---> MgO + H2O
Ta có: nMg(2+)trongD = nMgO = 4/40 = 0.1 mol
Trong đó 0.02 mol Mg(2+) được thêm vào bằng cách cho kim loại Mg vào (theo (*)), vậy còn lại 0.08 mol Mg(2+) là thêm từ đầu, ta có:
b = 0.08 mol_________________________(3)
(1), (2), (3) => a = 0.15, b = 0.08, c = 0.1
mKCl = 74.5*0.15 = 11.175 g
mMgCl2 = 95*0.08 = 7.6 g
mNaCl = 58.5*0.1 = 5.85 g

\(n_{Al}=\dfrac{2,7}{27}=0,1mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,1 0,3 0,1 0,15 ( mol )
\(m_{ddHCl}=\dfrac{0,3.36,5.100}{14,6}=75g\)
\(m_{ddspứ}=2,7+75-0,15.2=77,4g\)
\(C\%_{AlCl_3}=\dfrac{0,1.133,5}{77,4}.100=17,24\%\)
\(C\%_{H_2}=\dfrac{0,15.2}{77,4}.100=0,38\%\)

Đặt nMg=a(mol); nAl=b(mol)
PTHH: Mg +2 HCl -> MgCl2 + H2
a________2a_______a_____a(mol)
2 Al + 6 HCl -> 2 AlCl3 +3 H2
b_____3b____b_____1,5b(mol)
Ta có hpt: \(\left\{{}\begin{matrix}24a+27b=7,8\\a+1,5b=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
=> %mMg=[(0,1.24)/7,8].100=30,769%
=>%mAl= 69,231%
c) MgCl2 + 2 NaOH -> Mg(OH)2 + 2 NaCl
0,1_______________0,1(mol)
AlCl3 + 3 NaOH -> Al(OH)3 + 3 NaCl
0,2____________0,2(mol)
=> m=m(kết tủa)= mMg(OH)2+ mAl(OH)3= 58.0,1+ 78.0,2= 21,4(g)