Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích: Đáp án C
nMgCl2 = nNaCl = 0,2 mol => ∑nCl- = 0,2.2 + 0,2 = 0,6 mol
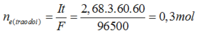
Tại catot: xảy ra quá trình oxi khử H2O Tại anot: Xảy ra quá trình oxi hóa Cl-
2H2O +2e → H2 + 2OH- 2Cl- → Cl2 + 2e
0,3 → 0,15 → 0,3 0,15←0,3
Khối lượng giảm = m↓ + m↑
= mMg(OH)2 + mH2 + mCl2
= 0,15.58 + 0,15.2 + 0,15.71 = 19,65g
Chú ý:
Tính khối lượng kết tủa của Mg(OH)2

Chọn A
Ta có n e ( trao đổi ) = It 96500 = 0 , 34 mol . Các quá trình điện phân diễn ra như sau:
| Tại catot |
Tại anot |
| Cu2+ + 2e → Cu a mol 2a mol → a mol
|
2Cl- → Cl2 + 2e 0,18 mol 0,09 mol 0,18 mol H2O → 4H+ + O2 + 4e 4b mol ← b mol → 4b mol |
Xét khối lượng giảm sau điện phân ta có:
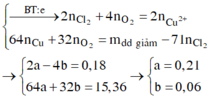
Dung dịch sau điện phân chứa: Na+, H+ (0,24 mol) và NO3- (0,5 mol) và Cu2+ (0,04 mol)
Khi cho dung dịch sau điện phân tác dụng với Fe dư thì:

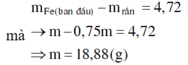

Giải thích: Đáp án D
Do dung dịch sau điện phân chứa 2 chất là: Na2SO4 và NaOH. Tỉ lệ mol CuSO4 và NaCl là 1:3 nên Cu2+ bị điện phân hết trước.
Al2O3+2OH- → 2AlO2-+H2O
=>nOH-=2nAl2O3=0,05 mol.
Quá trình điện phân:
Cu2+ + 2Cl- →Cu + Cl2
a 2a a a
2Cl- + 2H2O → Cl2 + H2 + 2OH-
a(=3a-2a) 0,5a 0,5a a=0,05
m giảm=64a+71a+71.0,5a+2.0,5a=8,575 gam<10,375
=> H2O bị điện phân: mH2O=10,375-8,575=1,8 gam
H2O→H2+0,5O2
0,1 0,1 0,05 mol
Tại anot: 0,075 mol Cl2, 0,05 mol O2
=> ne=0,075.2+0,05.4=0,35 mol=>t=ne.96500/I=0,35.96500/2,68=12602,6 giây=3,5 giờ.

Vì 2nCuSO4 < nNaCl ⇒ Al2O3 bị hòa tan bởi OH–.
Ta có nAl2O3 = 0,025 mol ⇒ nOH– cần dùng = 0,05 mol.
⇒ nNaOH = 0,05 mol.
Vì Dung dịch chỉ chứa 2 chất tan ⇒ Cl– đã bị điện phân hết và 2 chất tan đó là Na2SO4 và NaOH.
⇒ mGiảm = mCu + mCl– + mH2
Û mGiảm = 0,05×64 + 0,15×35,5 + 0,05×1 = 8,575 < 10,375
⇒ Nước có điện phân (10,375 – 8,575) = 1,8 gam ⇒ nH2O = 0,1 mol.
⇒ ∑ne nhận = 2nCu + 2nH2 + 2nH2O = 0,1 + 0,05 + 0,2 = 0,35 mol.
⇒ t = ≈ 12602,6s ≈ 3,5 giờ
Đáp án D







Đáp án D.