



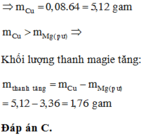
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




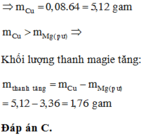

Chọn đáp án D
Vì nhúng Mg vào dung dịch sau điện phân có H2 sinh ra Þ Có H+
Nếu dung dịch sau điện phân không có Cu2+ thì mThanh Mg giảm = 0,16x24 = 3,84 gam
Þ Cu2+ chưa bị điện phân hết
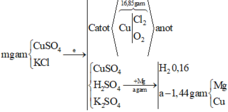
nH2 = 0,16 Þ nO2 ở anot = 0,16/2 = 0,08
Đặt nCu bị điện phân là x => nCl2 = x - 0,08x2 = x - 0,16
Þ 16,85 = 64x + 71x(x - 0,16) + 32x0,08 => x = 0,19
Đặt nCu2+ còn dư là y Þ nCu bám vào thanh Mg = 64y Þ nMg phản ứng = y + 0,16
Þ 1,44 = 24x(y + 0,16) - 64y Þ y = 0,06
BTNT.Cl Þ nKCl ban đầu = (0,19 - 0,16)x2 = 0,06
BTNT.Cu Þ nCuSO4 = x + y = 0,25
Vậy m = 0,25x160 + 0,06x74,5 = 44,47 Þ Đáp án A sai
Nếu thời gian điện phân là 9264 giây ứng với ne = 9264x5/96500 = 0,48 < 0,25x2 Þ Lúc này Cu2+ cũng chưa điện phân hết Þ H2O chưa điện phân ở catot Þ Đáp án B sai
Nếu thời gian điện phân là 10036 giây ứng với ne = 9264x5/96500 = 0,52 > 0,25x2 Þ Cu2+ đã điện phân hết Þ mCatot tăng = 0,25x64 = 16 gam Þ Đáp án C sai
Nếu thời gian điện phân là 9843 giây ứng với ne = 9843x5/96500 = 0,51 > 0,25x2 Þ Cu2+ đã điện phân hết Þ nH2 = 0,51/2 - 0,25 = 0,005; nO2 = (0,51 - 0,06)/4 = 0,1125
Tổng nKhí= 0,005 + 0,06/2 + 0,1125 = 0,1475 Þ Đáp án D đúng.

Đáp án A
Gọi số mol e lúc t giây là x.
Túc t giây thu được a mol khí ở 2 điện cực và b mol Cu.
Lúc t+2895s thì số mol e là x+0,06 mol thì thu được a+0,03 mol khí và b+0,02 mol Cu.
Ta có: 0,02. 2 < 0,06
chứng tỏ lúc này Cu2+ hết ở catot thu được thêm 0,02 mol Cu và 0,01 mol H2.
Vậy ở anot thu được 0,02 mol khí do vậy khí này gồm cả Cl2 và O2, giải được số mol Cl2 và O2 đều là 0,01 mol.
Vậy lúc t giây thu được số mol Cu là 0,5x=b và khí chỉ là Cl20,5x=a.
Lúc 2t giây thu được 2,125a mol khí và a+0,02 mol Cu.
Số mol e lúc này là 2x.
Ở catot thu được số mol H2 là 2 x - 0 , 5 x + 0 , 02 . 2 2 = 0 , 5 x - 0 , 02 mol
Ở anot thu được Cl2 là 0,5x +0,01 mol và O2 2 x - 0 , 5 x + 0 , 01 . 2 4 = 0 , 25 x - 0 , 005
→ 0,5x - 0,02 +0,5x + 0,01 + 0,25x - 0,005 = 2,125a = 2,125.0,5x
Giải được: x=0,08.
Vậy dung dịch ban đầu chứa CuSO4 0,06 mol và NaCl 0,1 mol.
Dừng điện phân ở thời điểm 5404 giây tức số mol e là 0,112 mol.
Ở catot thu được Cu: 0,056 mol.
Ở anot thu được Cl2 0,05 mol và O2 0,003 mol.
Do vậy dung dịch sau điện phân chứa Cu2+ dư 0,004 mol, H+ 0,012 mol, Na+ và SO42-.
Khi cho thanh Fe vào thì khối lượng thanh Fe giảm đi 0,006.56 - 0,004(64 - 56) = 0,304 gam

Chọn đáp án D.
Điện phân trong 2895s:
n đ i ệ n p h â n = 2895 . 2 96500 = 0 , 06 m o l > 2 . 0 , 02
⇒ n H 2 = 0 , 06 - 2 . 0 , 02 2 = 0 , 01 m o l
=> 0,02 mol khí còn lại gồm Cl2 (x mol) và O2 (y mol)
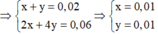
Trong khoảng thời gian từ (t + 2895) s đến 2s chỉ là điện phân H2O
nên phần khí tăng thêm là 2 , 125 a - a - 0 , 03 = 1 , 125 a - 0 , 03 chỉ gồm O2 và H2
Do n H 2 = 2 n O 2
nên n H 2 = 0 , 75 a - 0 , 02 n O 2 = 0 , 375 a - 0 , 01
Như vậy trong thời gian từ t đến 2t thì tại anot có:
⇒ n C l 2 = 0 , 01 m o l n O 2 = 0 , 374 a - 0 , 01 + y = 0 , 375 a
Bảo toàn electron cho cực dương ở 2 khoảng thời gian (0 – t) và (t – 2t) có:
![]()
![]()
![]()
Điện phân 5404 s:
n C u 2 + đ i ệ n p h â n = 5404 . 2 2 . 96500 = 0 , 056 m o l
⇒ n C u 2 + = 0 , 04 + 0 , 02 - 0 , 056 = 0 , 004 m o l
⇒ Tại anot đã xảy ra điện phân H2O:
n H + = 0 , 112 - 0 , 1 = 0 , 012 m o l
⇒ ∆ m t h a n h F e = - 0 , 304 g
=> Khối lượng thanh sắt giảm 0,304 g

Đáp án C
n N a C l = 0 , 18 m o l
Điện phân dung dịch X sau một thơi gian thấy giảm 18,65 gam
Cho Fe vào dung dịch thu được 0,035 mol NO do vậy dung dịch có H+. Do đó Cl- bị điện phân hết trước Cu2+.
Ta có: 3 F e + 8 H + + 2 N O 3 - → 3 F e 2 + + 2 N O + 4 H 2 O
(do Fe dư).
Lượng Fe bị ăn mòn do phản ứng này là chính bằng khối lượng thanh Fe giảm.
Do vậy Cu2+ bị điện phân hết
Ta có: n H + = 0 , 035 . 4 = 0 , 14 m o l → n C u + = 0 , 18 + 0 , 14 2 = 0 , 16 m o l
Vậy: m H 2 O đ p = 18 , 65 - 0 , 16 . 64 - 0 , 09 . 71 - 0 , 035 . 32 = 0 , 9 g a m
→ n H 2 O = 0 , 05 m o l → n e = 0 , 18 + 0 , 14 + 0 , 05 . 2 = 0 , 42 m o l → t = 8106