Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Ta có nMgO = 0,3 mol ⇒ nO2↑ khi chưa sinh ra H2 = 0,15 mol.
Đặt nCu = a || nH2 = b ⇒ ∑nO2↑ = 0,15 + 0,5b || nCl2 = c ta có:
+ PT theo khí thoát ra ở 2 cực: 1,5b + c = 0,25 (1).
+ PT bảo toàn e: 2a – 2c = 0,6 (2).
+ PT theo tỉ lệ n C u n C l = 2 : a – 4c = 0 (3).
+ Giải hệ (1) (2) và (3) ⇒ a = 0,4, b = c = 0,1 <=> nCl2 = 0,1.
⇒ Ở 2t giây tổng số mol e nhường = 2nCl2 + 4nO2 = 1 mol.
⇒ Tổng số mol e nhường ở t giây = 1 ÷ 2 = 0,5.
⇒ V lít khí gồm 0,1 mol Cl2 và 0,075 mol O2.
⇒ V = (0,1 + 0,075) × 22,4 = 3,92 lít

Do Y có phản ứng với kiềm nên R2+ có bị điện phân
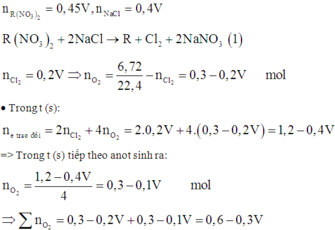
· Trường hợp 1: Trong 2t (s) R2+ chưa bị điện phân hết.
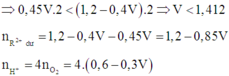
Thêm kiềm và không có kết tủa chứng tỏ R(OH)2 lưỡng tính đã tan trở lại.
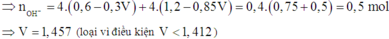
· Trường hợp 2: Trong 2t (s) đã xảy ra điệ phân nước ở catot.
Sau phản ứng (1):

=> Chọn đáp án B.

Đáp án B
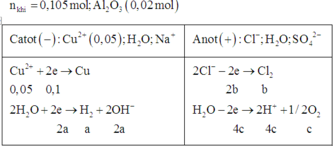
Dung dịch X hoàn tan Al2O3 ( oxit lưỡng tính )=>Trong dụng dịch X có ion OH- hoặc ion H+


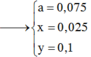


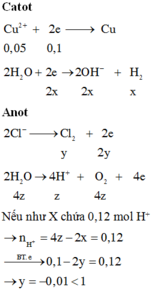
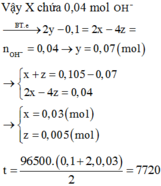

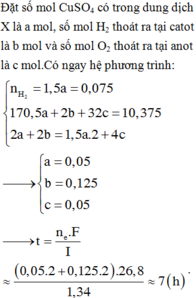
Đáp án B
► Dung dịch thu được không pứ với AgNO₃ ⇒ dung dịch thu được không còn Cl⁻
Ở đây ta cần chú ý, với H⁺ bị điện phân tại catot và anot bị điện phân H₂O
thì: 2H⁺ + 2e → H₂ || 2H₂O → 4H⁺ + O₂ + 4e ⇒ cộng lại cho khử e thì:
2H₂O → 2H₂ + O₂ ⇒ xem như điện phân H₂O ⇒ pH không đổi
Mà ta thấy sau t(s) đầu tới t(s) sau thì pH bị thay đổi
⇒ H₂O và H⁺ không bị điện phân cùng lúc ngay t(s) đầu
► Mặt khác, phần xem như điện phân H₂O không cần quan tâm vì không có gì đặc biệt
⇒ xét phần còn lại, thấy nH⁺ giảm = nH⁺ bị điện phân = 0,1 – 0,01 = 0,09 mol
nH⁺ sau khi điện phân t(s) = 0,1 mol = nHCl ban đầu ⇒ nCl⁻ = 0,1 mol
BTe: nCu = (0,1 – 0,09) = 0,005 mol