Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

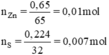
⇒ S phản ứng hết, Zn phản ứng dư
Phương trình hóa học của phản ứng
Zn + S  ZnS
ZnS
nZn phản ứng = 0,007 mol ⇒ nZnS = 0,007 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.

\(n_S=\frac{0,224}{32}=0,007mol\)
\(n_{Zn}=\frac{0,650}{65}=0,01mol\)
\(n_S\)\(<\)\(n_{Zn}\)
\(\rightarrow\) chất dư là Zn, số mol của pt tính theo S:
Zn + S \(\rightarrow\) ZnS
0,007 0,007 0,007 ( mol )
Sau pư chất thu được trong ống nghiệm là: Zn dư ; ZnS
\(n_{Zn\left(dư\right)}=0,01-0,007=0,003\left(mol\right)\)
\(m_{ZnS}=0,007.97=0,697\left(g\right)\)
\(m_{Zn\left(dư\right)}=0,003.65=0,195\left(g\right)\)

https://hoc24.vn/hoi-dap/question/578153.html
mình đã giải ở đó rồi

nFe = 0,1 mol
nS = 0,05 mol
PTHH : Fe + S --to--> FeS
a. Vì nFe > nS nên Fe dư sau phản ứng . A gồm FeS là Fe dư
b. Theo PT Trên , nFeS = nFe phản ứng = nS = 0,05 mol
có nFe dư = nFe ban đầu - nFe phản ứng = 0,1 -0,05 = 0,05 mol
⇒ mA = mFeS + mFe dư = 0,05.88 + 0,05.56 = 7,2 gam
Câu 2 :
nAl = 0,3 mol
nS = 0,3 mol
PTHH : 2Al + 3S --to--> Al2S3
a. Vì nAl .3/2 > nS nên Al dư . A gồm Al2O3 và Al dư
nAl phản ứng = 2/3 .nS = 0,2 mol
nAl2S3 =nS .1/3 =0,1 mol
có nAl dư = nAl ban đầu - nAl phản ứng = 0,3 -0,2 = 0,1 mol
⇒ mA = mAl2S3 + mAl dư = 0,1.150 + 0,1.27 = 17,7 gam

n Zn = 0,65/65 = 0,01 mol; n S = 0,224/32 = 0,007 mol
Zn + S → ZnS (1)
Theo (1) sau phản ứng trong ống nghiệm thu được:
n ZnS = 0,007 mol
m ZnS = 0,007x97 = 0,679 (g)
n Zn dư = (0,01 - 0,007) = 0,003 mol
m Zn dư = 65.0,003 = 0,195g

Do S không tan trong nước nên cho hỗn hợp trên vào nước rồi lọc sẽ thu được lưu huỳnh


Đáp án D
Để thu hồi lưu huỳnh rơi vãi trong phòng thí nghiệm người ta dùng bột lưu huỳnh vì:
Hg ( lỏng ) + S ( rắn ) → nhiệt độ thường HgS ( rắn )