Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo định luật bảo toàn khối lượng :
![]()
Đặt số mol C O 2 là a, số mol N2 là b, ta có :
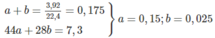
Khối lượng C: 0,150 x 12,0 = 1,80 (g).
Khối lượng H: 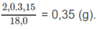
Khối lượng N: 0,0250 x 28,0 = 0,700 (g).
Khối lượng O: 4,48 - 1,80 - 0,35 - 0,700 = 1,60 (g).
Chất A có dạng C x H y N z O t
x : y ; z : t = 0,15 : 0,35 : 0,05 : 0,10 = 3 : 7 : 1 : 2
Công thức đơn giản nhất của A là C 3 H 7 N O 2

Khi đốt 0,5 mol hỗn hơp M, số mol C O 2 thu đươc là :
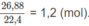
Nếu đốt 1 mol hỗn hợp M, số mol C O 2 thu được sẽ là 2,4 (mol).
Như vậy chất A và chất B có chứa trung bình 2,40 nguyên tử cacbon , chất A lại kém chất B 1 nguyên tử cacbon. Vậy, A có 2 và B có 3 nguyên tử cacbon.
A là ancol no có 2 cacbon: C 2 H 6 - x ( O H ) x hay C 2 H 6 O x
B là axit đơn chức có 3 cacbon: C 3 H y O 2 .
Đặt số mol A là a, số mol B là b :
a + b = 0,5 (1)
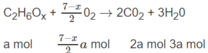
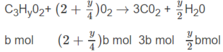
Số mol O 2 là: (3,5 - 0,5x)a + (2 + 0,25y)b = 1,35 (mol) (2)
Số mol C O 2 là: 2a + 3b = 1,2 (mol) (3)
Số mol C O 2 là:
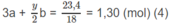
Giải hệ phương trình đại số tìm được: a = 0,3; b = 0,2; x = 2; y = 4.
Chất A:
C
2
H
6
O
2
hay 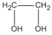 etanđiol (hay etylenglicol)
etanđiol (hay etylenglicol)
Chiếm  khối lượng M.
khối lượng M.
Chất B: C 3 H 4 O 2 hay C H 2 = C H - C O O H , axit propenoic chiếm 43,64% khối lượng M.

1. Theo định luật bảo toàn khối lượng:
m A = m C O 2 + m H 2 O − m O 2
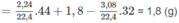
Khối lượng C trong 1,8 g A là: 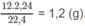
Khối lượng H trong 1,8 g A là: 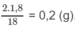
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng C x H y O z :
x : y : z = 0,1 : 0,2 : 0,025 = 4 : 8 : 1
CTĐGN là C 4 H 8 O
2. M A = 2,25.32 = 72 (g/mol)
⇒ CTPT trùng với CTĐGN: C 4 H 8 O .
3. Các hợp chất cacbonyl C 4 H 8 O :
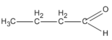 (butanal)
(butanal)
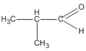 (2-metylpropanal)
(2-metylpropanal)
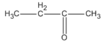 (butan-2-ol)
(butan-2-ol)

Đáp án C
Ta có mBình tăng = mCO2 + mH2O = 13,3 gam.
Với nCO2 = nBaCO3 = 0,2 mol ||⇒ nH2O = 0,25 mol.
Nhận thấy nC ÷ nH = 0,2 ÷ (0,25×2) = 2 ÷ 5

Đáp án C
Gọi công thức phân tử của X là CxHyNt
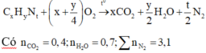
![]()
Mà thể tích trong không khí của O2 và N2 lần lượt là 20% và 80%
![]()
![]()
![]()
![]()
Vì CTĐGN của X cũng là CTPT
Nên CTPT của X là C2H7N

Số mol 2 chất trong 7,28g M: 
Số mol 2 chất trong 5,2g M: 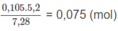
Theo định luật bảo toàn khối lượng:
m C O 2 + m H 2 O = m M + m O 2 = 12.4(g)
Theo đầu bài, số mol C O 2 = số mol H 2 O = n.
44n + 18n = 12,4 ⇒ n = 0,2 (mol)
Các chất trong hỗn hợp có chứa C, H và có thể có O. Chất thứ nhất là C X H Y O Z (a mol) và chất thứ 2 là C X + 2 H Y + 4 O Z (b mol).
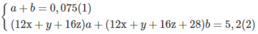
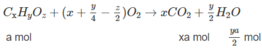
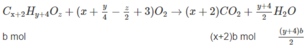
xa + (x + 2)b = 0,2 (3)
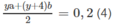
Giải hệ phương trình :
Từ (3) ta có x(a + b) + 2b = 0,200
2b = 0,200 - 0,0750x
b = 0,100 - 0,0375x
0 < b < 0,075 ⇒ 0 < 0,100 - 0,0375x < 0,0750
⇒ 0,660 < X < 2,66
Trong khoảng này có 2 số nguyên là 1 và 2.
Nếu x = 1.
b = 0,100 - 3.75. 10 - 2 = 0,0625
a = 0,0750 - 0,0625 = 0,0125.
Thay giá trị của a và b vào (4) ta có :
0125y + 0,0625(y + 4) = 0,400
⇒ y = 2.
Thay x = 1, y = 2; a = 0,0125, b = 0,0625 vào (2):
(14 + 16z).0,0125 + (42 + 16z).0,0625 = 5,20
⇒ z = 2.
C
H
2
O
2
chiếm: 
C 3 H 6 O 2 chiếm: 100% - 11,1% = 88,9%.
Nếu x = 2 .
b = 0,100 - 0,0375 X 2 = 0,0250
a = 0,0750 - 0,0250 = 0,05
từ đó tìm tiếp, ta được y = 4 và z = 2.
% khối lượng của
C
2
H
4
O
2
: 
% khối lương của C 4 H 8 O 2 : 100% - 57,7% = 42,3%.

a)
Gọi CT của ankan là CnH2n+2
CnH2n+2 + O2 \(\underrightarrow{t^o}\) nCO2 + (n+1)H2O
Theo đầu bài ta có: mCO2 + mH2O = 20,4
n = 3
Vậy CTPT của X là C3H8. …
Vì hỗn hợp Z tác dụng với dung dịch AgNO3/NH3 thu được kết tủa \(\rightarrow\) hiđrocacbon B có liên kết 3 đầu mạch.
Gọi CTTB của 2 hidrocacbon A và B là \(C_{\overline{x}}H_{\overline{y}}\)
\(C_{\overline{x}}H_{\overline{y}}\) + O2 \(\rightarrow\overline{x}\)CO2 + \(\frac{\overline{y}}{2}\)H2O
Theo đề bài ta có \(\overline{x}\) = 2,6 (vì \(\overline{x}\) = 2,6 nên hiđroccacbon B có số nguyên tử nhỏ hơn 2,6).
Vậy hiđrocacbon B là C2H2
Gọi \(n_{C_2H_2}=x,\) \(n_{C_3H_8}=y\) .Ta có: \(\begin{cases}x+y=0,1\\2x+3y=0,26\end{cases}\)\(\rightarrow\begin{cases}x=0,04\\y=0,06\end{cases}\)
Khối lượng kết tủa là C2Ag2 m = 9,6 gam

Ta có: \(n_{O_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
Theo ĐLBT KL, có: mX + mO2 = mH2O + mCO2 + mN2.
⇒ 44nCO2 + 28nN2 = 8,9 + 0,375.32 - 6,3 = 14,6 (1)
Mà: \(n_{CO_2}+n_{N_2}=\dfrac{7,84}{22,4}=0,35\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=0,3\left(mol\right)=n_C\\n_{N_2}=0,05\left(mol\right)\Rightarrow n_N=0,05.2=0,1\left(mol\right)\end{matrix}\right.\)
- Đốt cháy X thu CO2, H2O và N2 → X chứa C, H, N, có thể có O.
Ta có: \(n_{H_2O}=\dfrac{6,3}{18}=0,35\left(mol\right)\Rightarrow n_H=0,35.2=0,7\left(mol\right)\)
⇒ mC + mH + mN = 0,3.12 + 0,7.1 + 0,1.14 = 5,7 (g) < 8,9 (g)
Vậy: X chứa C, H, O và N.
⇒ mO = 8,9 - 5,7 = 3,2 (g) \(\Rightarrow n_O=\dfrac{3,2}{16}=0,2\left(mol\right)\)
Gọi CTPT của X là CxHyOzNt.
\(\Rightarrow x:y:z:t=0,3:0,7:0,2:0,1=3:7:2:1\)
Vậy: CTĐGN của X là C3H7O2N.
Đáp án A
,nO2 = 0,1875 mol
Bảo toàn khối lượng : mA + mO2 = mCO2 + mN2 + mH2O
=> mCO2 + mN2 = 7,3g
Mặt khác : nCO2 + nN2 = 0,175 mol
=> nCO2 = 0,15 ; nN2 = 0,025 mol
Bảo toàn O : nO(A) = 2nCO2 + nH2O – 2nO2 = 0,1 mol
=> nC : nH : nO : nN = 0,15 : 0,0,35 : 0,1 : 0,05 = 3 : 7 : 2 : 1
Vì A chỉ có 1 nguyên tử N nên A có CTPT là : C3H7O2N