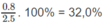Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. Công thức chung của hai ancol là C n H 2 n + 1 O H và tổng số mol của chúng là a. Khối lượng hỗn hợp: (14 n + 18)a.
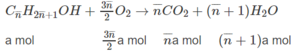
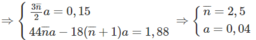
Khối lượng hỗn hợp: (14.2,5 + 18).0,04 = 2,12 (g)
2. n < 2,5 < n + 2 ⇒ 0,5 < n < 2,50
Phần cuối giống như ở cách giải 1.

1)
\(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)\)
\(n_{H_2O}=\dfrac{2,7}{18}=0,15\left(mol\right)\)
Bảo toàn C: nC = 0,2 (mol)
Bảo toàn H: nH = 0,3 (mol)
\(\left\{{}\begin{matrix}\%C=\dfrac{0,2.12}{4,3}.100\%=55,81\%\\\%H=\dfrac{0,3.1}{4,3}=6,97\%\\\%O=100\%-55,81\%-6,97\%=37,22\%\end{matrix}\right.\)
2)
\(n_O=\dfrac{4,3-0,2.12-0,3}{16}=0,1\left(mol\right)\)
nC : nH : nO = 0,2 : 0,3 : 0,1 = 2:3:1
=> CTPT: (C2H3O)n
Mà M = 43.2 = 86 (g/mol)
=> n = 2
=> CTPT: C4H6O2

Số mol
O
2
: 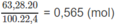
Số mol C O 2 = số mol C a C O 3 = 0,36 (mol).
1. Trong 0,36 mol C O 2 , khối lượng cacbon: 0,36 x 12 = 4,32 (g) và khối lượng oxi: 0,36 x 32 = 11,52 (g).
Khối lượng oxi trong nước là: 0,565 x 32,0 - 11,52 = 6,56 (g).
Khối lương hiđro (trong nước): 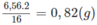
Khối lượng M = khối lượng C + khối lượng H = 4,32 + 0,82 = 5,14 (g)
2. Khi đốt 1 mol ankan, số mol H 2 O tạo ra nhiều hơn số mol C O 2 là 1 mol. Khi đốt hỗn hợp M, số mol H 2 O nhiều hơn số mol C O 2 :
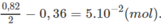
Vậy hỗn hợp M có 5. 10 - 2 mol ankan.
Khối lượng trung bình của 1 mol ankan:
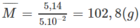
14n + 2 < 102,8 < 14n + 30
⇒ 5,20 < n < 7,20
Đến đây có thể tìm được công thức phân tử và phần trăm khối lượng từng chất như ở cách thứ nhất.

Khi đốt 0,5 mol hỗn hơp M, số mol C O 2 thu đươc là :
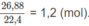
Nếu đốt 1 mol hỗn hợp M, số mol C O 2 thu được sẽ là 2,4 (mol).
Như vậy chất A và chất B có chứa trung bình 2,40 nguyên tử cacbon , chất A lại kém chất B 1 nguyên tử cacbon. Vậy, A có 2 và B có 3 nguyên tử cacbon.
A là ancol no có 2 cacbon: C 2 H 6 - x ( O H ) x hay C 2 H 6 O x
B là axit đơn chức có 3 cacbon: C 3 H y O 2 .
Đặt số mol A là a, số mol B là b :
a + b = 0,5 (1)
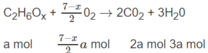
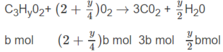
Số mol O 2 là: (3,5 - 0,5x)a + (2 + 0,25y)b = 1,35 (mol) (2)
Số mol C O 2 là: 2a + 3b = 1,2 (mol) (3)
Số mol C O 2 là:
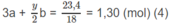
Giải hệ phương trình đại số tìm được: a = 0,3; b = 0,2; x = 2; y = 4.
Chất A:
C
2
H
6
O
2
hay 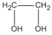 etanđiol (hay etylenglicol)
etanđiol (hay etylenglicol)
Chiếm  khối lượng M.
khối lượng M.
Chất B: C 3 H 4 O 2 hay C H 2 = C H - C O O H , axit propenoic chiếm 43,64% khối lượng M.

Đặt lượng C 7 H 16 là x mol, lượng C 8 H 18 là y mol.
100x + 114y = 6,95 (1)
C 7 H 16 + 11 O 2 → 7 C O 2 + 8H2O
x mol 11x mol
2 C 8 H 18 + 25 O 2 → 16 C O 2 + 18 C O 2
y mol 12,5 y mol
11x + 12,5y = 0,7625 (2)
Từ (1) và (2), tìm được x = 0,0125; y = 0,05.
% về khối lượng của
C
7
H
16
: 
% về khối lượng của C 8 H 18 : 100% - 18% = 82,0%.
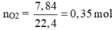
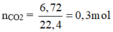
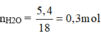
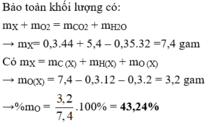
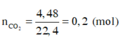
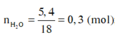
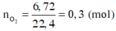
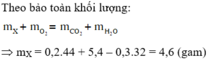
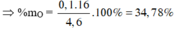
Khi A tác dụng với O 2 chỉ sinh ra, và H 2 O , vậy A có chứa cacbon, hiđro, có thể có hoặc không có oxi.
Theo định luật bảo toàn khối lượng :
m C O 2 + m H 2 O = m A + m O 2 = 7,30 (g) (1)
Theo đầu bài: m C O 2 + m H 2 O = 3,70(g). (2)
Từ hệ (1) và (2), tìm được m C O 2 = 5,50 g; m H 2 O = 1,80 g.
Khối lượng C trong 5,50 g C O 2 :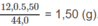
Khối lượng H trong 1,8 g H 2 :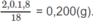
Đó cũng là khối lượng c và H trong 2,50 g chất A. Vậy chất A phải chứa O.
Khối lượng O trong 2,50 g A: 2,50 - 1,50 - 0,200 = 0,80 (g)
Phần trăm khối lượng của C: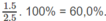
Phần trăm khối lương của H: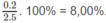
Phần trăm khối lương của O: