Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Xác định thành phần của hỗn hợp khí :
- Số mol CO 2 có trong hỗn hợp được tính theo (1) :
n CO 2 = n CaCO 3 = 1/100 = 0,01 mol
- Số mol CO có trong hỗn hợp được tính theo (2) :
n CO = n Cu = 0,64/64 = 0,01
Thành phần phần trăm theo thể tích của hỗn hợp khí được tính theo số mol của mỗi khí. Ta có kết quả : Hỗn hợp khí có 50% thể tích của mỗi khí.

Các phương trình hoá học :
- CO 2 tác dụng với dung dịch Ca OH 2 dư, sinh ra kết tủa CaCO 3 :
CO 2 + Ca OH 2 → CaCO 3 ↓+ H 2 O (1)
- CO khử CuO thành kim loại Cu màu đỏ :
CO + CuO → CO 2 + Cu (2)

a) Khi đi vào dd Ca(OH)2 dư thì chỉ có CO2 phản ứng
CO2 + Ca(OH)2 --> CaCO3↓ + H2O
nCaCO3 = 1/100 = 0,01 mol = nCO2
Khi đi qua CuO dư đun nóng thì chỉ có CO phản ứng
CO + CuO --> CO2 + Cu
nCu = 0,64/64 = 0,01 mol = nCO
b) vậy hỗn hợp gồm CO và CO2 đều có số mol là 0,01 mol
=> % V mỗi khí = 50%
c) 2CO + O2 --> 2CO2
=> nO2 = \(\dfrac{nCO}{2}\)= 0,05 mol
=> Thể tích khí oxi cần dùng để đốt cháy hỗn hợp CO và CO2 là 0,05.22,4 = 1,12 lít.

1.
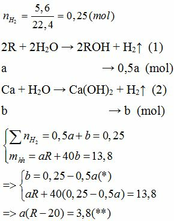
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
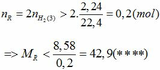
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
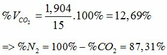
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
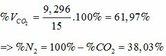

CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,34 ←0,34
CO + O(Oxit) → CO2
Nhận thấy:
nO = nCO2
mX = mO (oxit) + mY
=> mY = 37,68 – 16 . 0,34 = 32,24g

nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g
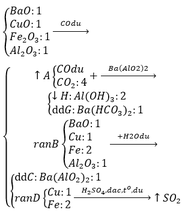
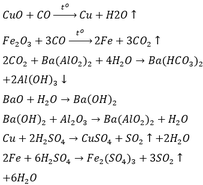


Tham khảo