Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
Dễ dàng suy ra được (1) KNO3; (2) HNO3; (3) H2SO4
3Cu + 8H+ + 2 N O 3 - → 3Cu2+ +2NO +4H2O
(1) và (2)
Bđ 1 2
Pư 1 0,25 0,25
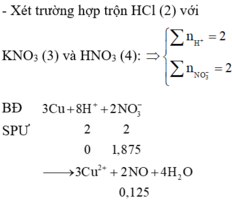
(3) và (4)
Bđ 3 1
Pư 3 0,75 0,75

Đáp án : C
Nhận thấy thể tích và nồng độ các dung dịch đều bằng nhau và đổ kiểu gì thì vẫn có dư. Do đó vấn đề chỉ liên quan tới H+. Dựa vào phản ứng :
(1) là dung dịch KNO3.
(2) là dung dịch HNO3.
(3) là dung dịch H2SO4

Đáp án C
Vì có nồng độ bằng nhau và đều lấy 5ml ở mỗi lần nên ta đặt: n H 2 S O 4 = n K N O 3 = n H N O 3 = a
Ta thấy ở lần 2 nhiều gấp đôi lần 1 nên lượng H + ở lần 2 gấp đôi lần 1, do đó
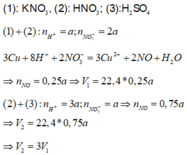

Đáp án C
Thí nhiệm 1: (1) + (2) + Cu dư → V1 lít NO
Thí nghiệm 2: (1) + (3) + Cu dư → 2V1 lít NO
Từ đó, dễ nhận thấy: Lượng H+ ở dung dịch (3) gấp đôi lượng H+ ở dung dịch (2).
Suy ra, (1) (2) (3) lần lượt là: KNO3, HNO3, H2SO4.
Xét phản ứng: ![]() .
.
Kết hợp dữ kiện ở thí nghiệm (1) và (3), dễ thấy: V2 = 3V1


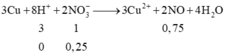







Chọn C
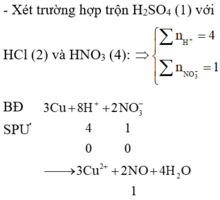
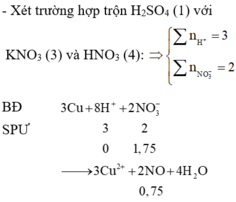
Vì: Pứ : 3Cu + 8H+ + 2NO3- → 3Cu + 2NO + 4H2O
Tổ hợp (1),(3),(4) => nH+ : nNO3 = 3 : 2 => nNO = 0,75
Tổ hợp (1),(3),(2) => nH+ : nNO3 = 3 : 1 => nNO = 0,75
Tổ hợp (1),(2),(4) => nH+ : nNO3 = 4 : 1 => nNO = 1
Tổ hợp (2),(3),(4) => nH+ : nNO3 = 2 : 2 => nNO = 0,5