Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.
|
|
AgNO3 |
K2CO3 |
| Ban đầu |
0,6 mol; 102 gam |
0,9 mol; 124,2 gam |
| Thêm vào |
→ HCl : 0 , 1 mol ↓ AgCl : 0 , 6 mol |
← H 2 SO 4 : 0 , 25 ↑ CO 2 : 0 , 25 |
| Sau phản ứng |
115,9gam |
213,2 gam |
| Thêm nước |
213,2 – 115,9 = 97,3 gam |
|
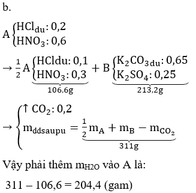

- Trường hợp 1: HCL dư
Có: n CaCO3 = \(\dfrac{a}{100}\left(mol\right)\)
n MgCO3 = \(\dfrac{a}{84}\left(mol\right)\)
PTHH
CaCO3 + 2HCl \(\rightarrow\) CaCL2 + CO2 + H2O
\(\dfrac{a}{100}\)--------------------------------\(\dfrac{a}{100}\)
MgCO3 + 2HCL \(\rightarrow\) MgCL2 + CO2 + H2O
\(\dfrac{a}{84}\)-----------------------------------\(\dfrac{a}{84}\)
theo pthh:
n CO2 ( cốc A ) < n CO2 ( cốc B )
=> m CO2 ( cốc A ) < m CO2 ( cốc B )
=> m cốc A sau phản ứng > m cốc B sau phản ứng
- Trường hợp 2 : HCL thiếu
Có:
n HCl ( cốc A ) = n HCl ( cốc B )
=> n CO2 ( cốc A ) = n CO2 ( cốc B )
=> m CO2 ( cốc A ) = m CO2 ( cốc B )

a) a(g) vào cốc CaCO3 xảy ra phản ứng:
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
b(g) vào cốc Cu xảy ra phản ứng:
\(Cu+H_2SO_4\rightarrow CuSO_4+SO_2+2H_2O\)
- Ở cốc 1 khối lượng tăng lên là (56/100)a. Ở cốc b khối lượng không thay đổi nên không thể xác định tỉ lệ a/b
b) \(CaCO_3+H_2SO_4\rightarrow CaSO_4+CO_2+2H_2O\)Cu vào cốc 1 không phản ứng.
Ở cốc 2, khối lượng tăng lên là: (56/100)a(g), cốc 2 tăng lên b(g)
Để cân thăng bằng thì (56/1000a=b=>a/b=100/56

Các phản ứng hoá học xảy ra trên hai đĩa cân :
CaCO 3 + 2 HNO 3 → Ca NO 3 2 + H 2 O + CO 2
MgCO 3 + 2 HNO 3 → Mg NO 3 2 + H 2 O + CO 2
Vị trí của hai đĩa cân trong thí nghiệm lần thứ nhất :
Số mol các chất tham gia ( 1 ) : n CaCO 3 = 20/100 = 0,2 mol bằng số mol HNO 3
Số mol các chất tham gia (2) : n MgCO 3 = 20/84 ≈ 0,24 mol nhiều hơn số mol HNO 3
Như vậy, toàn lượng HNO 3 đã tham gia các phản ứng (1) và (2). Mỗi phản ứng đều thoát ra một lượng khí CO 2 là 0,1 mol có khối lượng là 44 x 0,1 = 4,4 (gam). Sau khi các phản ứng kết thúc, 2 đĩa cân vẫn ở vị trí thăng bằng.
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)=n_{H_2}\) \(\Rightarrow m_{H_2}=0,05\cdot2=0,1\left(g\right)\)
\(\Rightarrow\) Cốc B nhẹ hơn cốc A là 0,1 gam