Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH :FexOy + 2yHCl ---> xFeCl2y/x + yH2O
FexOy + yCO => xFe + yCO2
Ta có
n HCl = 0,45 mol
n Fe = 0,15 mol
=> 0,45/2y = 0,15/x
=> x/y=2/3
CTPT Fe2O3

\(3Fe+2O_2\rightarrow Fe_3O_4\)
\(n_{Fe}=\frac{6,72}{22,4}=0,12\left(mol\right)\)
Cho hỗn hợp A tác dụng với HCl.
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
\(\%n_{Fe_{chuyen.hoa}}=\frac{0,1}{0,12}=83,33\%\)
\(n_{Fe3O4}=\frac{1}{2}n_{Fe_{pư}}=\frac{0,1}{3}\Rightarrow n_{FeCl3}=\frac{0,2}{3}\left(mol\right)\)
\(\Rightarrow n_{FeCl2}=0,12-\frac{0,2}{3}=\frac{4}{75}\left(mol\right)\)
\(\Rightarrow m_{FeCl3}=\frac{0,2}{3}.\left(56+35,5.3\right)=10,833\left(g\right)\)
\(\Rightarrow m_{FeCL2}=\frac{4}{75}.\left(56+35,5.2\right)=6,7733\left(g\right)\)

Đáp án C
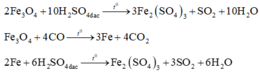
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.

Với lần thí nghiệm thứ nhất, có sự tham gia của O. Áp dụng định luật bảo toàn mol electron, ta có:
![]()
Với lần thí nghiệm thứ hai, không có sự tham gia của O. Áp dụng định luật bảo toàn mol
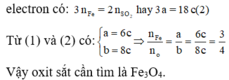

Đáp án C
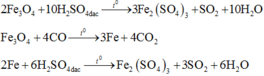
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.
Gọi thì ![]()
Các quá trình nhường và nhận electron diễn ra như sau:
Quá trình nhường electron:



Theo gt ta có: $n_{H_2}=0,08(mol)$
Bảo toàn e ta có: $n_{e}=0,16(mol)\Rightarrow n_{O_2}=\frac{n_e}{4}=0,04(mol)$
Do đó $m_{kl}=2,84-0,04.32=1,56(g)$
Suy ra $m_{klbđ}=2.1,56=3,12(g)$
Đặt M là KL chung có hóa trị là n
nH2=0,08
2M + 2nHCl --> 2MCln + nH2
0,16/n <-- 0,16 <-- 0,16/n <--0,08
4M + nO2 --> 2M2On
0,16/n --> 0,08/n
Bảo toàn nguyên tố Oxi: nO trong M2On = (0,08/n).n= 0,08 mol
-> nO2=0,08/2=0,04 mol --> mO2= 0,04.32=1,28g
Bảo toàn khối lượng: mM = mM2On - mO2= 2,84-1,28= 1,56g






Gọi CTHH: Fe2Ox
a, Fe2Ox+ 2xHCl-->2 FeClx+ xH2O
Ta có nHCl=3.0,15=0,45 mol
b, mình nghĩ là bạn ghi sai đề, CO2 ko PỨ vs oxit sắt , chỉ có CO thôi nhé