Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D
nCO2 dùng ở 2 thí nghiệm là như nhau nhưng TN2 cho nhiều BaCO3 hơn TN1
Þ Trong dung dịch sau phản ứng của TN1 còn Ba2+ cùng với CO32− hoặc HCO3-
Þ Dung dịch sau phản ứng của TN1 chỉ có Ba(HCO3)2.
Vậy ở TN1 bản chất là giống thí nghiệm 1 tạo ra 0,1 mol BaCO3 và dung dịch có a – 0,1 mol Ba(HCO3)2
Lượng NaOH thêm vào là a > nBa(HCO3)2 Þ Toàn bộ Ba2+ đã kết tủa
Þ a – 0,1 = 0,1 Þ a = 0,2; BTNT.C Þ nCO2 = 0,1 + 0,1.2 = 0,3 Þ V = 6,72.

Đáp án A
nOH- = 0,1.2 + 0,225 + 0,2 = 0,625 mol
Do nH+>nCO2 nên X có cả CO32- => X không có Ba2+ => nBaCO3 = 0,1 mol
Đặt x, y là số mol CO32- và số mol HCO3- phản ứng với H+
x+y = nCO2 = 0,25
2x+y = nH+ = 0,35
=> x = 0,1; y = 0,15
Dung dịch X chứa: K+ (0,225 mol), Na+ (0,2 mol), CO32- (0,1k mol), HCO3- (0,15k mol)
BTĐT: 0,225 + 0,2 = 2.0,1k + 0,15k => k = 1,3
BTNT C: nCO2 ban đầu = nBaCO3 + nCO32- + nHCO3- = 0,1 + 0,13 + 0,195 = 0,425 mol
=> V = 9,52 lít

Định hướng tư duy giải
Từ các đáp án → dung dịch chỉ có K+ và Na+
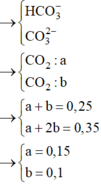
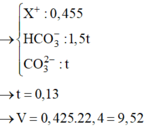

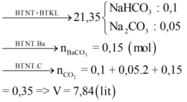
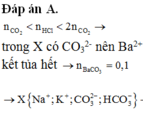
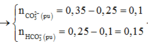
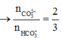
Đáp án B
n N a O H = 0 , 1 m o l
Giả sử dd muối không chứa B a 2 +
=> m muối ≤ 0,1 . 84 = 8,4g
Mà m m u ố i = 23,94 > 8,4
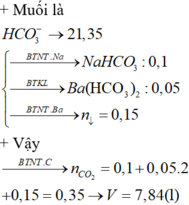
=> dd muối chứa N a H C O 3 ;
0,1 mol và B a H C O 3 2
=> n B a ( H C O 3 ) 2 = 0,06 mol
=> n B a C O 3 = 0,09 mol
Bảo toàn nguyên tố C
=> n C O 2 = 0,31 mol
=> V = 0,31 . 22,4 = 6,944 l