Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : A
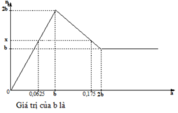
Tại nBa(OH)2 = 2b mol thì kết tủa ổn định => chỉ có BaSO4 ( x > b > 0,0625)
Tại nBa(OH)2 = 0,0625 và 0,175 mol thì đều có lượng kết tủa x như nhau
+) Tại : nBa(OH)2 = 0,0625 mol [ SO42- dư và Zn2+ dư ]
=> nBaSO4 = 0,0625 mol ; nZn(OH)2 = 0,0625 mol
+) Tại : nBa(OH)2 = 0,175 mol [ Ba2+ dư , có hòa tan kết tủa 1 phần]
=> nBaSO4 = b ; nZn(OH)2 = (2nZn2+ - ½ .nOH-) = (2b – ½ .0,175.2)
Số mol kết tủa là như nhau ở 2 thời điểm trên
=> 0,0625 + 0,0625 = b + (2b – ½ .0,175.2)
=> b = 0,1 mol

Đáp án C
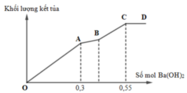
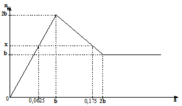
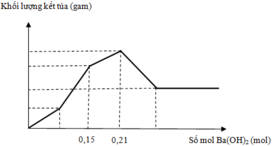
Đồ thị trải qua các giai đoạn:
+Kết tủa tăng dần do Ba(OH)2 tác dụng với ZnSO4 tạo kết tủa BaSO4 và Zn(OH)2.
+Kết tủa bị hòa tan do Ba(OH)2 hòa tan Zn(OH)2 đến khi không đổi, lúc này chỉ còn BaSO4.
Lúc 0,0625 mol Ba(OH)2 phản ứng thì kết tủa gồm 0,0625 mol BaSO4 và 0,0625 mol Zn(OH)2.
![]()
Lúc 0,175 mol Ba(OH)2 phản ứng thì kết tủa gồm BaSO4 b mol và Zn(OH)2 còn 2b-0,175 mol.
![]()
Kết tủa cực đại còn Zn(OH)2 0,1 mol và BaSO4 0,1 mol.
Khối lượng kết tủa cực đại là 33,2 gam

Đáp án : A
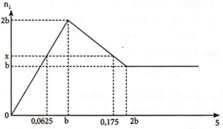
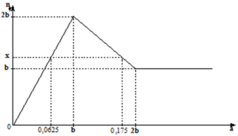
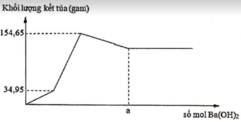
Ta thấy khi tạo x mol kết tủa thì có 2 giá trị của a thỏa mãn
+) TH1 : OH- hết trước => x = 0,5nOH = nBa(OH)2 = 0,0625 mol
=> nkết tủa = nZn(OH)2 + nBaSO4 = 0,0625 + 0,0625 = 0,125 mol
+) TH2 : kết tủa tan 1 phần
=> nkết tủa = nZn(OH)2 + nBaSO4 = nZn(OH)2 + b = 0,125 (mol)
2nZn(OH)2 = 4nZn2+ - nOH = 4b – 0,35 => nZn(OH)2 = 2b – 0,175 (mol)
=> b = 0,1 mol

Đáp án A
Tại nBa(OH)2 = 2b mol thì kết tủa ổn định => chỉ có BaSO4 ( x > b > 0,0625)
Tại nBa(OH)2 = 0,0625 và 0,175 mol thì đều có lượng kết tủa x như nhau
+) Tại : nBa(OH)2 = 0,0625 mol [ SO42- dư và Zn2+ dư ]
=> nBaSO4 = 0,0625 mol ; nZn(OH)2 = 0,0625 mol
+) Tại : nBa(OH)2 = 0,175 mol [ Ba2+ dư , có hòa tan kết tủa 1 phần]
=> nBaSO4 = b ; nZn(OH)2 = (2nZn2+ - ½ .nOH-) = (2b – ½ .0,175.2)
Số mol kết tủa là như nhau ở 2 thời điểm trên
=> 0,0625 + 0,0625 = b + (2b – ½ .0,175.2)
=> b = 0,1 mol

Đáp án D
![]()
![]()
![]()
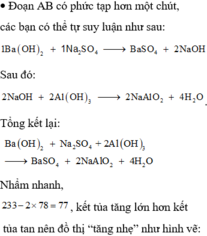
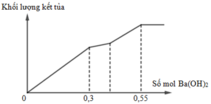
Đoạn BC biểu diễn tỉ lệ phản ứng:
![]()
Theo đó, tại điểm A, ta có số mol Ba(OH)2 dùng = 3a = 0,3 ® a = 0,1 mol.
Tại điểm C, sản phẩm thu được gồm: (3a + b) mol BaSO4; 2a mol NaAlO2; (2b – 2a) mol NaOH.
Theo đó, bảo toàn nguyên tố Ba có số mol Ba(OH)2 dùng = 3a + b = 0,55 ® b = 0,25 mol.
Vậy, tỉ lệ a : b = 0,1 ¸ 0,25 = 2 ¸ 5.



Chọn đáp án D.
Ba(OH)2 + ZnSO4 → BaSO4 + Zn(OH)2
Zn(OH)2 + Ba(OH)2 → BaZnO2 + 2H2O
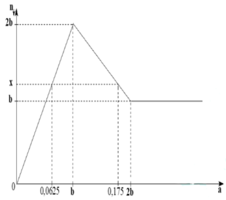
Dựa vào đồ thị ta quan sát được:
Khi a = b thì kết tủa đạt cực đại.
Khi a = 0,0625 hay a = 0,175 thì đều thu được x mol kết tủa