Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

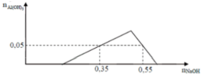
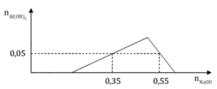
Tại nOH- = 0,35 thì Al(OH)3 chưa đạt cực đại ⇒ Al3+ còn dư
H+ + OH- → H2O
Al3+ + 3OH- → Al(OH)3
⇒ nOH- = nH+ + 3n↓ ⇒ 0,35 = x + 3.0,05 ⇒x = 0,2
Tại nOH- = 0,55 thì Al(OH)3 đạt cực đại và bị tan bớt 1 phần
H+ + OH- → H2O
0,2 → 0,2
Al3+ + 3OH- → Al(OH)3
y → 3y → y
Al(OH)3 + OH- → AlO2- + 2H2O
(y – 0,05) → (y – 0,05
⇒ nOH- = 0,2 + 3y + y – 0,05 = 0,55 ⇒ y = 0,1
Bảo toàn điện tích ⇒ 0,2 + 0,1.3 = 2z + 0,1 ⇒z = 0,2
Khi cho 0,27 mol Ba(OH)2 vào dung dịch X thì
Ba2+ + SO42- → BaSO4↓
0,2 → 0,2
H+ + OH- → H2O
0,2 → 0,2
Al3+ + 3OH- → Al(OH)3
0,1 → 0,3 → 0,1
Al(OH)3 + OH- → AlO2- + 2H2O
0,04 ← 0,04
⇒ mY = mBaSO4 + mAl(OH)3 = 0,2.233 + 0,06.78 = 51,28g ⇒ Chọn D.

Đáp án B
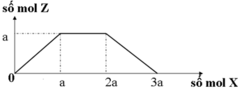
Dung dịch X chứa 2 chất tan là HCl dư và AlCl3 cùng số mol là a mol suy ra y=4a.
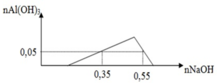
Đồ thị trải qua các giai đoạn:
+Kết tủa chưa xuất hiện do NaOH tác dụng với HCl dư.
+Kết tủa tăng dần tới cực đại do AlCl3 tác dụng với NaOH tạo kết tủa Al(OH)3.
+Kết tủa giảm dần do NaOH dư hòa tan kết tủa.
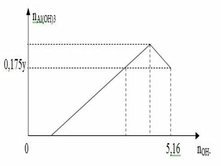
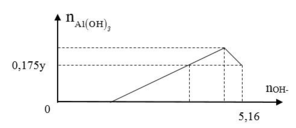
Nhận thấy khi thu được 0,175y mol hay 0,7x mol Al(OH)3 thì đã dùng 5,16 mol NaOH (giai đoạn hòa tan kết tủa.
![]()
![]()

Phân tích thí nghiệm của dung dịch X với NaOH
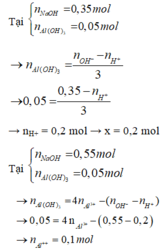

Thí nghiệm 2
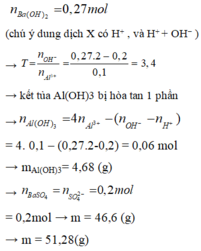
Đáp án C

Đáp án D
Ta có: x = 0,35 – 0,05.3 = 0,2
Tại điểm kết tủa cực đại là
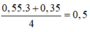
=> z = 0,2.
Khi thêm 0,27 Ba(OH)2 thì thu được kết tủa Z chứa
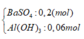
=> m = 51,28 gam
Đáp án D.