Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

BTNT Fe: nFe = nFeSO4.7H2O = 55,6/278 = 0,2 mol
=> nH2 = 0,2 mol => V = 0,2.22,4 = 4,48 lít
Đáp án A

Đáp án A
BTNT Fe: nFe = nFeSO4.7H2O = 55,6/278 = 0,2 mol => nH2 = 0,2 mol => V = 0,2.22,4 = 4,48 lít

Đáp án C.
Cứ 278 g FeSO4.7H2O có 152 g FeSO4
→ 55,6 g FeSO4.7H2O có x (g) FeSO4
Khối lượng FeSO4 là 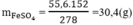
Số mol FeSO4: 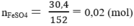
Fe + H2SO4 → FeSO4 + H2
nH2 = nFeSO4 = 0,2 (mol) ⇒ VH2 = 0,2.22,4 = 4,48 (lit)

Đáp án C
Lời giải : số mol của Fe :0,2 mol
Ta có Fe + 2HCl → FeCl2 + H2
Thì số mol của H2 : 0,2 mol nên V=4,48 lít

Chọn đáp án C
Áp dụng định luật bảo toàn electron có: n A g = 3 n N O = 3. 4 , 48 22 , 4 = 0 , 6 m o l
⇒ n H C H O = 1 4 n A g = 0 , 6 4 = 0 , 15 m o l ⇒ m C H 3 O H = 14 , 1 − 30.0 , 15 = 9 , 6 g ⇒ n C H 3 O H = 0 , 3 m o l m C H 3 C O O C H 3 = 74.0 , 3 = 22 , 2 g
⇒ Hiệu suất este hóa: H % = 16 , 65 22 , 2 .100 % = 75 %



