Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1
Mg+HCl->Mgcl2+H2
0,1--------------------0,1
n Mg=0,1 mol
=>VH2=0,1.22,4=2,24l
2
Fe+H2SO4->FeSO4+H2
0,1----------------------------0,1
n Fe=0,1 mol
=>VH2=0,1.22,4=2,24l
\(1,n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
PTHH: Mg + 2HCl ---> MgCl2 + H2
0,1 0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
\(2,n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
0,1 0,1
=> VH2 = 0,1.22,4 = 2,24 (l)

\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(3Zn+2H_3PO_4\rightarrow Zn_3\left(PO_4\right)_2+3H_2\)

a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 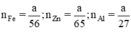
Theo pt nH2 (1) = nZn = 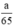 mol
mol
nH2 (2) = nFe = 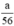 mol
mol
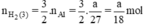
Như vậy ta nhận thấy 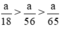 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.

![]()
Để điều chế 0,05 mol H 2 thì:
n Z n = n M g = 0,05 mol mà M M g < M Z n
⇒ Dùng Mg sẽ cần khối lượng nhỏ hơn
n H C l = 2 . n H 2 = 0,05 . 2 = 0,1 mol ⇒ m H C l = 0,1 . 36,5 = 3,65 g
n H 2 S O 4 = n H 2 = 0,05 mol ⇒ m H 2 S O 4 = 0,05 .98 = 4,9g
⇒ Dùng axit HCl sẽ cần khối lượng nhỏ hơn
Nên với những chất đã cho muốn dùng với khối lượng nhỏ nhất để điều chế H 2 ta dùng Mg và axit HCl

a)
$Zn + H_2SO_4 \to ZnSO_4 + H_2(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2(2)$
$Fe + H_2SO_4 \to FeSO_4 + H_2(3)$
b)
Coi m Zn = m Al = m Fe = 100(gam)
\(n_{H_2(1)} = n_{Zn} = \dfrac{100}{65}(mol)\\ n_{H_2(2)} = \dfrac{3}{2}n_{Al} = \dfrac{3}{2}.\dfrac{100}{27} = \dfrac{100}{18}(mol)\\ n_{H_2(3)} = n_{Fe} = \dfrac{100}{56}(mol)\\\)
Ta thấy :
\(n_{H_2(1)} < n_{H_2(3)} < n_{H_2(2)}\) nên dùng kim loại Al cho được nhiều khí hidro nhất.
c) Coi $n_{H_2} = 1(mol)$
n Zn = n H2 = 1(mol) => m Zn = 1.65 = 65(gam)
n Al = 3/2 n H2 = 1,5(mol) => m Al = 1,5.27 = 40,5(gam)
n Fe = n H2 = 1(mol) => m Fe = 1.56 = 56(gam)
Vậy cùng một thể tích hidro thì Al có khối lượng nhỏ nhất
a, PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\) (2)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (3)
b, Giả sử: mZn = mAl = mFe = a (g)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{Al}=\dfrac{a}{27}\left(mol\right)\\n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{H_2\left(2\right)}=\dfrac{3}{2}n_{Al}=\dfrac{a}{18}\left(mol\right)\\n_{H_2\left(3\right)}=n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
⇒ Al cho nhiều khí H2 nhất.
c, Giả sử: nH2 (1) = nH2 (2) = nH2 (3) = b (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{Zn}=n_{H_2\left(1\right)}=b\left(mol\right)\\n_{Al}=\dfrac{2}{3}n_{H_2\left(2\right)}=\dfrac{2}{3}b\left(mol\right)\\n_{Fe}=n_{H_2\left(3\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=65b\left(g\right)\\m_{Al}=\dfrac{2}{3}b.27=18b\left(g\right)\\m_{Fe}=56b\left(g\right)\end{matrix}\right.\)
⇒ Khối lượng Al pư là nhỏ nhất.

2Na + 2HCl -> 2NaCl + H2
2Na + H2SO4 -> Na2SO4 + H2
6Na + 2H3PO4 -> 2Na3PO4 + 3H2
2Al + 6HCl -> 2AlCl3 + 3H2
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
2Al + 2H3PO4 -> 2AlPO4 + 3H2
Mg + 2HCl -> MgCl2 + H2
Mg + H2SO4 -> MgSO4 + H2
3Mg + 2H3PO4 -> Mg3(PO4)2 + 3H2
viết PTHH hả em