
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

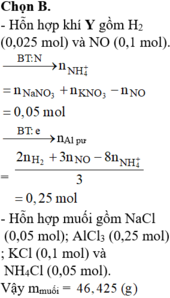

Chọn đáp án B
MY = 24,4 ⇒ Y chứa H2 và NO. Đặt nH2 = x mol; nNO = y mol ⇒ nY = x + y = 0,125 mol
mY = 2x + 30y = 0,125 × 24,4. Giải hệ có: x = 0,025 mol; y = 0,1 mol.
Do Y chứa H2 ⇒ X không chứa NO3–. Bảo toàn nguyên tố Nitơ:
nNH4+ = 0,05 + 0,1 – 0,1 = 0,05 mol. Bảo toàn electron: 3nAl phản ứng = 2nH2 + 3nNO + 8nNH4+
⇒ nAl phản ứng = 0,25 mol. X chứa AlCl3, NaCl, KCl, NH4Cl
⇒ m = 0,25 × 133,5 + 0,05 × 58,5 + 0,1 × 74,5 + 0,05 × 53,5 = 46,425 gam.

Đáp án : A
Hỗn hợp khí gồm NO và H2.
(NO3- phải hết)
Áp dụng qui tắc đường chéo :
=> nNO = 0,1 mol ; nH2 = 0,025 mol
Bảo toàn N (giả sử có x mol NH4+ ) => x + nNO = nNaNO3 +nHNO3
=> x = 0,05 mol
Bảo toàn e : 2nZn = 2nH2 + 3nNO + 8nNH4+
Tính được nZn = 0,375 mol; nNH4+ = 0,05 mol
Muối có 
=> m = 64,05g

Đáp án : A
Ta có : MY = 24,4 => Có H2. Lại có 1 khí hóa nâu ngoài không khí => NO
Áp dụng qui tắc đường chéo ta có : nH2= 0,025 mol ; nNO = 0,1 mol
Do Zn dư và tạo ra khí H2 => NO3 hết => trong dung dịch sau không còn NO3-
Bảo toàn N : nNH4+ = nNO3 ban đầu – nNO = 0,05 mol
=> 2nZn = 2nH2 + 3nNO + 8nNH4+ => 0,375 mol = nZn2+
Bảo toàn điện tích : 2nZn2+ + nNa+ + nK+ + nNH4+ = nCl
=> nCl- = 0,95 mol
=> m = 64,05g

Đáp án D
Vì hỗn hợp khí thu được có dY/H2 = 12,2 => Mkhí = 12,2.2 = 24,4
Có 1 khí hóa nâu ngoài không khí (NO có M = 30 > 24,4) => khí còn lại có M < 24,4
=> Chỉ có thể là H2 => NO3- hết trước H+.
Ta có: nNO + nH2 = 0,125 mol (1)
Và: mkhí = 30nNO + 2nH2 = 0,125.24,4 = 3,05g (2)
Từ (1,2) => nNO = 0,1 ; nH2 = 0,025 mol
Bảo toàn N: nNaNO3 + nKNO3 = nNO + nNH4 (nếu có)
=> nNH4 = 0,05 mol
Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8nNH4 + 2nH2 = 3.0,1 + 8.0,05 + 0,025.2 = 0,75 mol
Và: nMg = nAl (Đề bài)
=> nMg = nAl = 0,15 mol
Vậy dung dịch X chứa: 0,15 mol Mg2+ ; 0,15 mol Al3+ ; 0,05 mol Na+ ; 0,1 mol K+ ; 0,05 mol NH4+ ; Cl-
Bảo toàn điện tích: nCl = 2nMg + 3nAl + nNa + nK + nNH4 = 0,95 mol
=> m = Smion = 0,15.24 + 0,15.27 + 0,05.23 + 0,1.39 + 0,05.18 + 0,95.35,5 = 47,235g (Gần nhất với giá trị 47,3g)

Đáp án D
Vì hỗn hợp khí thu được có dY/H2 = 12,2 => Mkhí = 12,2.2 = 24,4
Có 1 khí hóa nâu ngoài không khí (NO có M = 30 > 24,4) => khí còn lại có M < 24,4
=> Chỉ có thể là H2 => NO3- hết trước H+.
Ta có: nNO + nH2 = 0,125 mol (1)
Và: mkhí = 30nNO + 2nH2 = 0,125.24,4 = 3,05g (2)
Từ (1,2) => nNO = 0,1 ; nH2 = 0,025 mol
Bảo toàn nguyên tố N: nNaNO3 + nKNO3 = nNO + nNH4 (nếu có)
=> nNH4 = 0,05 mol
Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8nNH4 + 2nH2 = 3.0,1 + 8.0,05 + 0,025.2 = 0,75 mol
Và: nMg = nAl (Đề bài)
=> nMg = nAl = 0,15 mol
Vậy dung dịch X chứa: 0,15 mol Mg2+ ; 0,15 mol Al3+ ; 0,05 mol Na+ ; 0,1 mol K+ ; 0,05 mol NH4+ ; Cl-
Bảo toàn điện tích: nCl = 2nMg + 3nAl + nNa + nK + nNH4 = 0,95 mol
=> m = åmion = 0,15.24 + 0,15.27 + 0,05.23 + 0,1.39 + 0,05.18 + 0,95.35,5 = 47,235g (Gần nhất với giá trị 47,3g)

Đáp án C
Khí không màu hóa nâu trong kk là NO. Vì tỷ khối của 2 khí là 24,4 nên có 1 khí là H 2
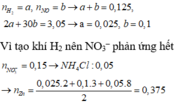
⇒ mMuối = mZnCl2 + mNH4Cl + mNaCl + mKCl = 64,05 gam