Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Các phản ứng đều là kim loại đẩy kim loại ra khỏi dung dịch muối → anion → được bảo toàn.
Thứ tự các kim loại trong dãy điện hóa: Zn > Fe > Cu > Ag.
Theo đó, dung dịch cuối cùng chỉ chứa một muối duy nhất là 0,02 mol Zn(NO3)2.
ó Phản ứng: 5,2 gam Zn + ? gam Y → 0,02 mol Zn(NO3)2 + 5,82 gam chất rắn Z.
→ bảo toàn khối lượng ta cóm=4,4 gam.
ó Phản ứng: m gam (Cu, Fe) + 0,04 mol AgNO3 → 4,4 gam Y + 4,16 gam chất rắn X.
→ bảo toàn khối lượng ta có m = 4,4 + 4,16 – 0,04´170 = 1,76 gam

Chọn đáp án A.
Các phản ứng đều là kim loại đẩy kim loại ra khỏi dung dịch muối " anion N O 3 - được bảo toàn.
Thứ tự các kim loại trong dãy điện hóa: Zn > Fe > Cu > Ag.
Theo đó, dung dịch cuối cùng chỉ chứa một muối duy nhất là 0,02 mol Zn(NO3)2
* Phản ứng: 5,2 gam Zn + ? gam Y " 0,02 mol Zn(NO3)2 + 5,82 gam chất rắn Z.
" bảo toàn khối lượng ta có mY = 0,02 × 189 + 5,82 - 5,2 = 4,4 gam.
* Phản ứng: m gam (Cu, Fe) + 0,04 mol AgNO3 " 4,4 gam Y + 4,16 gam chất rắn X.
" bảo toàn khối lượng ta có m = 4,4 + 4,16 - 0,04 × 170 = 1,76 gam

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:

Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL:
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: ![]()
![]()

Đáp án D
nAgNO3 = 0,036 mol
nCu(NO3)2 = 0,024 mol
Xét cả quá trình phản ứng, ta thấy chỉ có Mg nhường e và Ag+, Cu2+ nhận e.
Bte: 2nMg pư = nAg+ + 2nCu2+ => nMg pư = (0,036 + 2.0,024):2 = 0,042 mol
=> nMg dư = 0,08 – 0,042 = 0,038 mol
Ta có: mX + mY = m + mAg + mCu + mMg dư => 4,21 + 4,826 = m + 0,036.108 + 0,024.64 + 0,038.24
=> m = 2,7 gam

Đáp án C

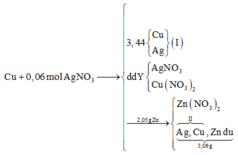
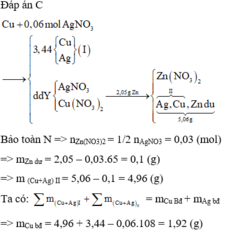
Bảo toàn N => nZn(NO3)2 = 1/2nAgNO3 = 0,03 (mol)
=> mZn dư = 2,05 – 0,03.65 = 0,1 (g)
=> m (Cu + Ag )II = 5,06 – 0,1 = 4,96 (g)
Ta có: ∑ m( Cu + Ag)I + ∑ m( Cu + Ag) II = mCu bđ + mAgbđ
=> mCu bđ = 4,96 + 3,44 – 0,06.108 = 1,92 (g)

Bảo toàn N => nZn(NO3)2 = 1/2 nAgNO3 = 0,03 (mol)
=> mZn dư = 2,05 – 0,03.65 = 0,1 (g)
=> m (Cu+Ag) II = 5,06 – 0,1 = 4,96 (g)
Ta có: = mCu Bđ + mAg bđ
=> mCu bđ = 4,96 + 3,44 – 0,06.108 = 1,92 (g)
Đáp án C

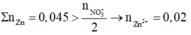
Đáp án B