Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
phần 1: 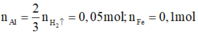
phản ứng : 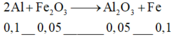
![]()
![]()
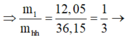
lượng phần 2 gấp đối phần 1
phần 2: 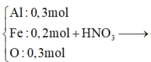
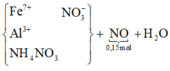
Ta có: ![]()
![]()
![]()
=>bảo toàn nguyên tố H có: ![]()
bảo toàn khối lượng:![]()
![]()

Đáp án A
Phần 1: ![]()
Phản ứng: 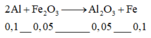
![]()
= 12,05 gam
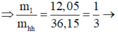 lượng phần 2 gấp đối phần 1
lượng phần 2 gấp đối phần 1
Phần 2: 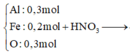
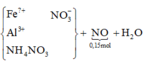
Ta có: ![]()
![]()
![]()
=> bảo toàn nguyên tố H có: ![]()
bảo toàn khối lượng: mmuối = 2.12,05 + 1,7.63 - 0,15.30 - 0,75.18 = 113,2 gam

Đáp án A
![]()
· Phần 1 + NaOH dư → 0,075 mol H2 + 5,6g Fe
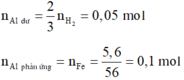
· Phần 2 + 1,7 mol HNO3 → 0,15 mol NO + m gam muối
=> HNO3 phản ứng hết.
Giả sử phần 2 có khối lượng gấp k lần phần 1.
=> ![]()
=> k = 2
=> Phần 2 gồm: 0,2 mol Fe, 0,1 mol Al, 0,1 mol Al2O3.
Đặt a, b lần lượt là số mol của Fe2+, Fe3+ tạo thành.
a + b = 0 , 2 → b t e 2 a + 3 b + 3 . 0 , 1 = 3 . 0 , 15 + 8 n N H 4 N O 3 = 1 , 7 m o l n H N O 3 = 2 a + 3 b + 3 ( 0 , 1 + 2 . 0 , 1 ) + 0 , 15 + 2 n N H 4 N O 3 = 1 , 7 m o l
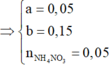
![]()
![]()
Gần nhất với giá trị 113

Đáp án A
Ta có khối lượng mỗi phần là 30,66 gam.
Cho phần một tác dụng với NaOH dư thu được 0,09 mol H2 do vậy trong X chứa Al dư.
Vậy trong mỗi phần chứa Fe, Al2O3 và Al dư 0,06 mol.
Cho phần 2 tác dụng với 1,74 mol HNO3 thu được 0,18 mol NO. Cô cạn dung dịch Y thu được các muối, nung rắn tới khối lượng không đổi thu được rắn chứa Al2O3 và Fe2O3 có số mol bằng nhau.
Gọi số mol của Fe, Al2O3 trong mỗi phần lần lượt là a, b
![]()
Và a=2b+0,06
Giải hệ: a=0,3; b=0,12.
Gọi x là số mol NH4NO3 có thể tạo ra.
Bảo toàn N:
n N O 3 - t r o n g m u o i K l = 1 , 74 - 0 , 18 - 2 x = 1 , 56 - 2 x
Bảo toàn e: 1 , 56 - 2 x = 0 , 12 . 6 + 0 , 18 . 3 + 8 x
Vậy NO3– trong muối là 1,5 mol.
Muối trong Y gồm Al(NO3)3 0,3 mol, Fe(NO3)2 0,3 mol và NH4NO3 0,03 mol.
Cho Y tác dụng với Na2CO3 dư thu được kết tủa là Al(OH)3 0,3 mol và FeCO3 0,3 mol.
→ a = 58 , 2 g
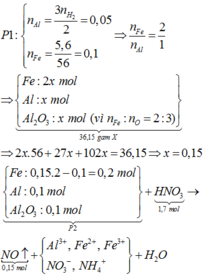
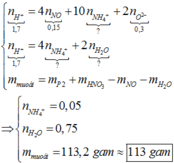


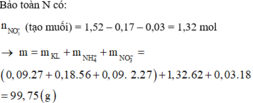
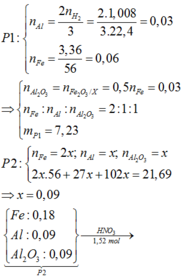

Giải thích:
Ở phần 1 khi cho tác dụng với NaOH có sinh ra khí H2 => nhôm dư
Phần 1
nH2 = 0,0525 mol => nAl dư = 0,035 mol
chất rắn không tan tác dụng với HCl => nH2 = 0,045 mol => nFe = 0,045 mol
Phần 2
nH2 = 0,2925 mol
Giả sử phần 2 = k. phần 1
Bảo toàn e ở phần 2 ta có (3 . 0,035 + 2 . 0,045) . k = 2 . 0,2925 => k = 3
Có mA = mB = 4 khối lượng phần 1
=> tổng lượng H2 ở thí nghiệm 1 = 4 . (0,0525 + 0,045 ) = 0,39
=> nFe3O4 = (4 . 0,045) : 3 = 0,06 mol
=> 3nAl = 2.nFe3O4 + 2nH2 => nAl = 0,3 mol
=> mA = 0,3 . 27 + 0,06 . 232 = 22,02 mol
%Al = 37% và %Fe3O4 = 63%
Đáp án A