Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án là A.
hc = πR3 → bán kính giảm 2 lần thì thể tích giảm 8 lần → 7 8 lượng Al đã phản ứng
n H 2 S O 4 = 0 , 105 → n A l ( p u ) = 0 , 015 . 2 3 = 0 , 07 → m = 0 , 07 . 27 . 8 7 = 2 , 16

Đáp án B
Ta có: nNaOH = 0,15 mol; nBa(OH)2 = 0,05 mol
Dung dịch Y chứa 0,15 mol Na+, 0,05 mol Ba2+, u mol AlO2- và v mol OH- dư
Định luật bảo toàn điện tích ta có u + v = 0,15 + 0,05.2 = 0,25 (1)
Ta có: nHCl = 0,32 mol và nH2SO4 = 0,04 mol→ nH+ = 0,4 mol; nSO4(2-) = 0,04 mol
→ nBaSO4 = 0,04 mol
Ta có: mkết tủa = 21,02 gam → nAl(OH)3 = 0,15 mol
Nếu Al(OH)3 chưa bị hòa tan thì nH+ = 0,4 = v + 0,15 (2)
Nếu Al(OH)3 đã bị hòa tan thì nH+ = 0,4 = v + 4u - 3.0,15 (3)
Giải hệ (1) và (2) ra vô nghiệm
Giải hệ (1) và (3) ra u = 0,2 và v = 0,05
Vậy Y gồm Na+ 0,15 mol; 0,05 mol Ba2+; 0,2 mol AlO2- và OH- dư (0,05 mol)
V lít dung dịch Z gồm 0,64V mol HCl và 0,08V mol H2SO4
→ nH+ = 0,8V mol và nSO4(2-) = 0,08 V mol
Khi Al(OH)3 max thì 0,8V = u+ v suy ra V = 0,3125
Suy ra nBaSO4 = 0,025 mol → mkết tủa = 21,425 gam
Khi BaSO4 max thì 0,08V = 0,05 suy ra V = 0,625
Suy ra nH+ = 0,8V = v + 4u-3.nAl(OH)3 → nAl(OH)3 = 7/60 mol → mkết tủa = 20,75 gam
Vậy mkết tủa max = 21,425 gam

Đáp án A
Dung dịch X chứa H2SO4: 0,1 mol và HCl 0,05 mol; Y chứa KHCO3: 0,15 mol và BaCl2: 0,05 mol
Khối lượng dung dịch giảm chính bằng khối lượng chất rắn được hình thành và khí thoát ra
Þ BaSO4 (0,05 mol) và CO2 (0,15 mol) Þ m = 18,25 (g)
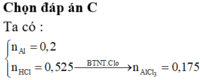




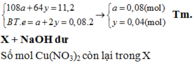
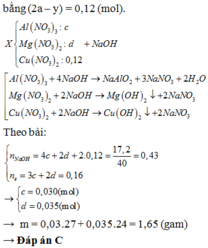

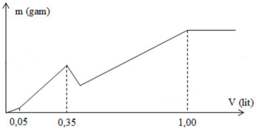
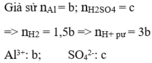

Đáp án A.
Bán kính quả cầu giảm 2 lần nên thể tích quả cầu giảm 8 lần, do đó 7/8 lượng Al đã tham gia phản ứng.