Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Dùng phương pháp đường chéo tính được mol CO2 là 0,2 mol và H2 là 0,15 mol.
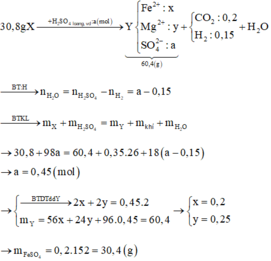

Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n Cu = n SO 2 = 0 , 075 mol.
Đặt n Cr = x mol; n Fe = y mol → m X 52x + 56y + 0,075 × 64 = 18,2 gam.
x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
mCr trong X = 42,86% và %mCu trong X = 26,37%
Đáp án A

Đáp án D
m gam Fe3O4 + H2 → hỗn hợp X gồm Fe, FeO.
Hỗn hợp X + 0,6 mol H2SO4.
Ta có : Fe + 2H+ → Fe2+ + H2↑
FeO + 2H+ → Fe2+ + H2O
nFe + nFeO = nH+ : 2 = 0,6 × 2 : 2 = 0,6 mol
→ nFe3O4 = 1/3 × (nFe + nFeO) = 1/3 × 0,6 = 0,2 mol
→ mFe3O4 = 0,2 × 232 = 46,4 gam

Đáp án B
Giả sử số mol Al là x thì số mol Na là 1,25x.
Cho X tác dụng với H2O thì số mol H2 thu được là 2,125x mol.
Z tác dụng với H2SO4 loãng thu được 0,25V lít khí tức 0,53125x mol.
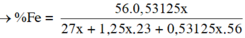
= 74,795 %

Đáp án C
Ta có ![]()
![]()
=> mcác kim loại = ![]()
Chuỗi phản ứng: ![]()
![]()
![]()
![]()
=> nO oxi hóa FeO thành Fe2O3 =1,57 - 1,37 = 0,2 mol
Phản ứng: ![]()
= 0,2.2 = 0,4 mol
![]()
![]()

Đáp án A
Fe3O4 → FeO , Fe → FeSO4
Nhận thấy sau phản ứng chỉ thu được FeSO4 → nFeSO4 = nSO4 2- = 0,6 mol
Bảo toàn nguyên tố Fe → nFe3O4 = 0,6: 3= 0,2 mol
→ m= 46,4 gam.