Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án A
Hỗn hợp K2CO3 và NaHCO3 (tỉ lệ mol 1 : 1) + Ba(HCO3)2 → ↓X + ddY.
Thêm 0,28 mol HCl vào bình.
Y + 0,2 mol NaOH.
• Đặt nK2CO3 = nNaHCO3 = x mol; nBa(HCO3)2 = y mol.
ddY + 0,2 mol NaOH → nHCO3- = 0,2 mol → x + 2y = 0,2 (*).
Bình + 0,28 mol HCl → 2x + (x + 2y) = 0,28 (**).
Từ (*), (**) → x = 0,04 mol; y = 0,08 mol → mBaCO3 = 0,04 x 197 = 7,88 gam.
⇒ Chọn A

Đáp án B
Dung dịch Y có HCO3- phản ứng NaOH tỉ lệ mol 1:1 nên nHCO3- trong Y= 0,2 mol
Gọi số mol K2CO3 là x và Ba(HCO3)2 là y.
Khi phản ứng HCl ta có số mol HCl = 2x+x+2y=0,28 hay 3x+2y=0,28;
nHCO3- = x+2y = 0,2 nên x = 0,04 và y =0,08.
Vậy nBaCO3 = x=0,04 ⇒m= 7,88g

Đáp án A
· HCl + Z chưa có khí thoát ra ngay Þ Z chứa CO 3 2 - dư, Ba2+ phản ứng hết.
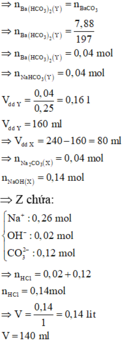


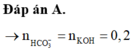
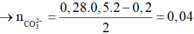
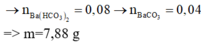
Chọn đáp án B
Đặt nK2CO3 = nNaHCO3 = a và nBa(HCO3)2 = b.
+ Phương tình theo nHCl ⇒ a + 2a + 2b = 0,28 3a + 2b = 0,28 (1).
+ Phương tình theo NaOH ⇒ a + 2b = 0,2 (2)
⇒ Giải hệ (1) và (2) ⇒ nK2CO3 = 0,04 và nBa(HCO3)2 = 0,08
⇒ nBaCO3 = 0,04 ⇒ m↓ = 7,88 gam ⇒ Chọn B