Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
M tác dụng Fe(NO3)3 và AgNO3 thu được 2 kim loại M và Ag và 2 muối. Pt như sau:
M + Fe3+ → M2+ + Fe2+. Ta có cặp điện cực M2+/M đứng trước Fe3+/Fe2+.
M + Ag+ → M2+ + Ag. Ta có cặp điện cực M2+/M đứng trước Ag+/Ag
Vì không tạo ra kim loại Fe nên M có tính khử yếu hơn Fe
Sắp xếp các cặp điện cực theo dãy điện hóa
Fe2+/Fe ; M2+/M ; Fe3+/Fe2+ ; Ag+/Ag.
Tính khử theo thứ tự: Fe > M > Fe2+ > Ag
Tính oxi hóa theo thứ tự: Ag+ > Fe3+ > M2+ > Fe2+

Đáp án B
Cho Y chứa 3 kim loại, tác dụng
với dung dịch HCl dư thu được
0,035 mol khí H2 → Y chứa Fe dư
Vậy Y chứa Cu: x mol ,
Ag: x mol và Fe dư: 0,035 mol
⇒ Fe pư: 0,05 - 0,035 = 0,015 mol
Bảo toàn electron
2nCu(NO3)2 + nAgNO3 = 2nFe + 3nAl
⇒ 2x + x = 2. 0,015 + 0,03. 3
→ x = 0,04 mol
⇒ CMCu(NO3)2 = CMAgNO3
= 0,04 : 0,1 = 0,4M

Đáp án B
- Thứ tự phản ứng của muối: AgNO3, Cu(NO3)2
- Thứ tự phản ứng của KL: Al, Fe
Do sau phản ứng thu được 3 KL nên suy ra 3 KL đó là Ag, Cu, Fe dư.
Khi Y + HCl chỉ có Fe phản ứng: Fe + 2HCl → FeCl2 + H2 (nH2 = 0,07: 2 = 0,035 mol)
Xét toàn bộ quá trình:
Quá trình nhường e:
Al → Al3+ + 3e
Fe → Fe2+ + 2e
=> n e nhường = 3nAl + 2nFe
Quá trình nhận e:
Ag+ + 1e → Ag
Cu2+ + 2e → Cu
2H+ + 2e → H2
=> n e nhận = nAg + 2nCu + 2nH2
BTe: n e nhường = n e nhận => 3nAl + 2nFe = nAg + 2nCu + 2nH2 => 3.0,03 + 0,05.2 = x + 2x + 0,035.2
=> x = 0,04 mol => CM = n: V = 0,04: 0,1 = 0,4M

Chọn B
Y + HCl tạo 0,035 mol H2 ⇒ nFe dư = 0,035 ⇒ nFe phản ứng với muối = 0,05 – 0,035 = 0,015
Bảo toàn ne ⇒ nAg+ + 2nCu2+ = 3nAl + 2nFe = 0,12
Do Ag+ và Cu2+ cùng nồng độ ⇒ nAg+ = nCu2+ = 0,04 ⇒ [Ag+] = [Cu2+] = 0,04/0,1 = 0,4M
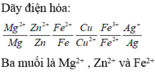

Đáp án : C