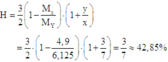Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử nN2 = 1mol ⇒ nH2 = 4 mol
N2 + 3H2 → 2NH3
a 3a 2a
Thể tích khí sau phản ứng là: 5 – 4a + 2a = 5 – 2a
B có 20% NH3 theo thể tích ⇒ 2a : (5 – 2a) = 0,2
⇒ a = 0,4167 ⇒ H = 41,67%
Đáp án C.

nN2=56/28=2(mol)
nH2=18/18=1(mol)
nNH3= 8,5/17=0,5(mol)
PTHH: N2 +3 H2 \(⇌\left(xt,to\right)\) 2 NH3
Vì 2/1 > 1/3 khác 0,5/2
=> Sau phản ứng có cả 3 khí: NH3, N2, H2
\(\left\{{}\begin{matrix}nNH3=0,5\left(mol\right)\\nH2=1-0,5.\dfrac{3}{2}=0,25\left(mol\right)\\nN2=2-\dfrac{1}{2}.0,5=1,75\left(mol\right)\end{matrix}\right.\)
Số mol tỉ lệ thuận thể tích. Nên ta có phần trăm thể tích hỗn hợp khí sau p.ứ là:
%V(NH3)= (0,5/2,5).100=20%
%V(H2)=(0,25/2,5).100=10%
%V(N2)=(1,75/2,5).100=70%

Đáp án B
Áp dụng phương pháp đường chéo cho hỗn hợp X:
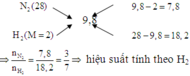
Cách 1: Gọi số mol N2 là 3x thì số mol H2 là 7x ⇒ tổng số mol hỗn hợp X là 3x + 7x = 10x
Thay vào công thức:
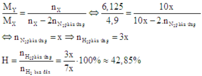
Cách 2: Áp dụng công thức tính nhanh với trường hợp x < 3y:
Hiệu suất phản ứng: