Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dạng bài KL có tính khử mạnh như Al, Mg… tác dụng với HNO3 (hoặc H2SO4) cần chú ý sản phẩm có thể có muối NH4NO3.
- Ta có hệ:
nN2 + nN2O = 0.24 mol
28nN2 + 44nN2O = 0.24*18*2 g
=> nN2 = 0.12 mol; nN2O = 0.12 mol
- Bảo toàn electron cho phản ứng:
3nAl = 10nN2 + 8nN2O + 8nNH4NO3
=> 3*m/27 = 10*0.12 + 8*0.12 + 8*nNH3NO3
=> nNH3NO3 = m/72 – 0.27 (mol)
- Khối lượng muối tạo thành: mmuối = mAl(NO3)3 + mNH3NO3
=> 8m = 213*(m/27) + 80*( m/72 – 0.27)
=> m = 21.6 g
=> Đáp án D

Đáp án D.
Chất bị oxi hóa bởi H2SO4 đặc, nóng là: FeBr3; FeCl2; Fe3O4; AlBr3; MgI2; KBr.

Chọn đáp án B
Các chất bị oxi hóa bời dung dịch H2SO4 đặc, nóng khi chúng chưa đạt số oxi hóa tối đa, gồm 4 chất là Cu, Fe3O4, C và FeCO3

Chọn C
Chất bị oxi hóa khi tác dụng với HNO3 thì phải chưa đạt hóa trị tối đa Trong dãy trên có 4 chất là: FeO, Fe(OH)2, FeSO4 và Fe3O4.

Chọn C.
Chất bị oxi hóa khi tác dụng với dung dịch HNO3 đặc, nóng là FeO, Fe(OH)2, FeSO4, Fe3O4.
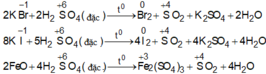
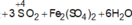
Đáp án : B
Trừ Fe2O3, SiO2, Na3PO4
Lưu ý phản ứng của KBr: 2H2SO4 + 2KBr → Br2 + 2H2O + SO2 + K2SO4