Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
MX = 0,4.58 = 23,2 nên mX = 0,6.23,2 = 13,92 g
Do đó 0,6 mol X được tạo từ 13,92 : 58 = 0,24 mol C4H10
nX – nC4H10 = nH2 = 0,6 - 0,24 = 0,36 mol
X + Br2 thì nBr2 = nH2 = 0,36 mol

Đáp án D
MX = 0,4.58 = 23,2 nên mX = 0,6.23,2 = 13,92 g
Do đó 0,6 mol X được tạo từ 13,92 : 58 = 0,24 mol C4H10
nX – nC4H10 = nH2 = 0,6 - 0,24 = 0,36 mol
X + Br2 thì nBr2 = nH2 = 0,36 mol

Ta có: \(\overline{M_X}=0,4.58=23,2\left(g/mol\right)\)
Có: mC4H10 = mX
⇒ 58nC4H10 = 0,6.23,2
⇒ nC4H10 = 0,24 (mol)
\(C_4H_{10}\rightarrow C_4H_8+H_2\)
x_________x_____x (mol)
\(C_4H_{10}\rightarrow C_4H_6+2H_2\)
y_________y______2y (mol)
⇒ nC4H10 (dư) = 0,24 - x - y (mol)
Mà: nX = 0,6 (mol)
\(\Rightarrow x+x+y+2y+0,24-x-y=0,6\)
\(\Rightarrow x+2y=0,36=n_{H_2}=n_{\pi\left(trongX\right)}=n_{Br_2}\)

Các pt
C4H10 --> C4H8 + H2 (1)
C4H10 --> C4H6 +2H2 (2)
C4H8 + Br2 --> C4H8Br2 (3)
C4H6 + 2Br2 --> C4H6Br4 (4)
Gọi nC4H10 (1) =x (mol)
nC4H10 (2) =y (mol)
nC4H10 (bđ) \(\approx\) 0,256 (mol)
=> nC4H10 (dư) = 0,256 -x-y (mol)
Theo (1) : nC4H8=x(mol) , nH2(1) =x(mol)
Theo (2) : nC4H6=y(mol) , nH2(2) = 2y(mol)
Mà m(khí bđ) = m (khí sau pư)
=> m ( khí sau pư )= 0,256.58=14,848(g)
n (khí sau pư ) = 14,848 / 0,4.58 =0,64(mol)
=> 0,64 =x+x+y+2y + 0,256 -x- y <=> x+2y=0,384
Theo (3,4) : nBr2 = nC4H8+ 2nC4H6 = x+2y=0,384
=> nBr2(pư) =0,384(mol)

mh cũng k biết. đây là bài tập mh lấy trên mạng về làm nên k có đáp án

Đáp án B
hhX gồm axetilen và etan (tỉ lệ mol 1 : 3) qua xt, to
→ hhY gồm CH3-CH3, CH2=CH2, CH≡CH và H2, dY/H2 = 58/7.
Giả sử có 1 mol CH≡CH và 3 mol H2 ban đầu.
Theo BTKL: mY = mX = 1 x 26 + 3 x 30 = 116 gam
→ nY = 116 : (58/7 x 2) = 7 mol.
nH2 = nY - nX = 7 - 4 = 3 mol.
nliên kết π trong 7 mol Y = 2 x nCH≡CH + nH2 = 5.
nBr2 = nliên kết π trong 0,7 mol Y = 0,5 mol

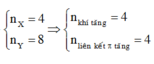
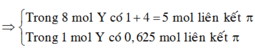
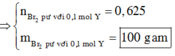
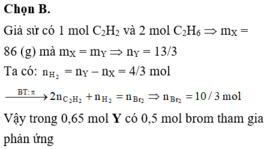
\(M_X=0.4\cdot58=23.2\left(\dfrac{g}{mol}\right)\)
\(m_X=0.6\cdot23.2=13.92\left(g\right)\)
\(n_{C_4H_{10}}=\dfrac{13.92}{58}=0.24\left(mol\right)\)
\(n_{H_2}=0.6-0.24=0.36\left(mol\right)\)
\(n_{H_2}=n_{Br_2}=0.36\left(mol\right)\)
\(\)