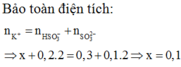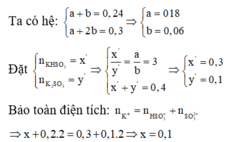Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol SO2 và NaOH lần lượt là 0,2 và 0,25.
1 < OH-/SO2=1,25 < 2 ⇒ Dung dịch X chứa hai muối Na2SO3 và NaHSO3.
\(n_{Na_2SO_3}=0,25-0,2=0,05\left(mol\right)\) ⇒ \(n_{NaHSO_3}=0,2-0,05=0,15\left(mol\right)\).
1. Khối lượng muối có trong X:
m=0,05.126+0,15.104=21,9 (g).
2. Nồng độ mol/l các chất trong X:
\(C_{M\left(Na_2SO_3\right)}\)=0,05/0,2=0,25 (mol/l).
\(C_{M\left(NaHSO_3\right)}\)=0,15/0,2=0,75 (mol/l).
3. Khối lượng kết tủa BaSO3 là:
m'=0,2.217=43,4 (g).

SO2+Ba(OH)2--->BaSO3+H2O
SO2+BaSO3+H2O--->Ba(HSO3)2
n SO2=6,272/22,4=0,28(mol)
n BaSO3=26,04/217=0,12(mol)
Do n SO2> n BaSO3-->Sau phản ứng tạo 2 muối BaSO3 và Ba(HSO3)2
Áp dụng bảo toàn nguyên tố ta có
n Ba(HCO3)=1/2 (n CO2-n BaSO3)=0,08(mol)
Gọi nồng độ mol của Ba(OH)2 là a
--> n ba(OH)2=1,5a=n BaSO3+n Ba(HSO3)2=0,12+0,08=0,2(mol)
CM Ba(OH)2=0,2/0,25=0,8(M)
có: nSO2= 0,28( mol)
nBaSO3= 0,12( mol)
vì nSO2> nBaSO3 nên sau phản ứng sinh ra 2 muối là BaSO3\(\downarrow\) và Ba(HSO3)2 tan trong dd
gọi a là số mol Ba(OH)2 có trong dd
PTPU
SO2+ Ba(OH)2\(\rightarrow\) BaSO3\(\downarrow\)+ H2O
. a.......a..................a....................... mol
BaSO3+ SO2+ H2O\(\rightarrow\) Ba(HSO3)2
(0,28-a)...(0,28-a)................................ mol
có 0,12= a-( 0,28- a)
\(\Rightarrow\) a= 0,2
\(\Rightarrow\) CM Ba(OH)2= \(\frac{0,2}{2,5}\)= 0,08M

Kí hiệu CO 2 và SO 2 là YO 2 => Σn YO 2 cần dùng = 0,25 mol
Chất tan sinh ra khi dung dịch NaOH hấp thụ tối đa YO 2 sẽ là NaHYO 3
YO 2 + NaOH → NaHYO 3
a = 0,25/0,5 = 0,5 (mol/l)

\(n_{SO_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
nNaOH = 0,4.x (mol)
- Nếu chất rắn sau pư gồm Na2SO3, NaHSO3
PTHH: 2NaOH + SO2 --> Na2SO3 + H2O
0,4x-->0,2x----->0,2x
Na2SO3 + SO2 + H2O --> 2NaHSO3
(0,12-0,2x)<-(0,12-0,2x)----->(0,24-0,4x)
=> hh rắn \(\left\{{}\begin{matrix}Na_2SO_3:0,4x-0,12\left(mol\right)\\NaHSO_3:0,24-0,4x\left(mol\right)\end{matrix}\right.\)
=> 126(0,4x - 0,12) + 104(0,24 - 0,4x) = 17,52
=> \(x=\dfrac{48}{55}\)( Thử lại => Không thỏa mãn)
- Nếu rắn sau pư là Na2SO3
\(n_{Na_2SO_3}=\dfrac{17,52}{126}=\dfrac{73}{525}\left(mol\right)\)
Bảo toàn S: nSO2 = \(\dfrac{73}{525}\) (mol) => Vô lí
- Nếu rắn sau pư là NaHSO3
\(n_{NaHSO_3}=\dfrac{17,52}{104}=\dfrac{219}{1300}\left(mol\right)\)
Bảo toàn S: \(n_{SO_2}=\dfrac{219}{1300}\left(mol\right)\) => Vô lí
- Nếu rắn sau pư gồm Na2SO3 và NaOHdư
PTHH: 2NaOH + SO2 --> Na2SO3 + H2O
0,24<---0,12----->0,12
=> hh rắn \(\left\{{}\begin{matrix}NaOH:0,4x-0,24\left(mol\right)\\Na_2SO_3:0,12\left(mol\right)\end{matrix}\right.\)
=> 40(0,4x - 0,24) + 0,12.126 = 17,52
=> x = 0,75 (Thử lại => Thỏa mãn)
Vậy x = 0,75

Đáp án C.
nBa(OH)2= 0,1.2 = 0,2 (mol); nBaSO3 = 0,1 (mol)
nBaSO3 = 2 nBa(OH)2 - nSO2 ⇒ nSO2 = 2.0,2 – 0,1 = 0,3 (mol)
FeS2 → 2SO2 (Bảo toàn S)
0,15 0,3 (mol)
⇒ mFeS2 = 0,15.(56+32.2) = 18 (g)