Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Mg}=n_{Al}=xmol\)
2Mg+O2\(\overset{t^0}{\rightarrow}\)2MgO
x\(\rightarrow\)\(\dfrac{x}{2}\)
4Al+3O2\(\overset{t^0}{\rightarrow}\)2Al2O3
x\(\rightarrow\)\(\dfrac{3x}{4}\)
-Độ tăng khối lượng chất rắn=\(m_{O_2}\)\(m_{O_2}=2gam\rightarrow n_{O_2}=\dfrac{m}{M}=\dfrac{2}{32}=0,0625mol\)
-Ta có: \(\dfrac{x}{2}+\dfrac{3x}{4}=0,0625\rightarrow\dfrac{2x+3x}{4}=0,0625\)
\(\rightarrow\)5x=4.0,0625=0,25\(\rightarrow\)x=0,05
m=\(m_{Mg}+m_{Al}=\left(24+27\right)x=51x=51.0,05=2,55gam\)

n C u S O 4 = 0,525.0,2 = 0,105 m o l
Vì thu được kết tủa là 2 kim loại nên Fe còn dư.
Suy ra, kết tủa là Fe dư và C u , C u S O 4 phản ứng hết.
Gọi a, b, c là số mol của Al phản ứng, Fe phản ứng và Fe dư.
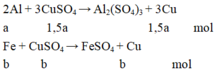
Từ phương trình phản ứng và dữ kiện đề bài cho, ta lập được hệ phương trình:
3 2 a + b = n C u S O 4 a .27 + b .56 + c .56 = m K L 3 2 a .64 + b .64 + c .56 = m k e t t u a ⇔ 3 2 a + b = 0,105 27 a + 56 b + 56 c = 4,15 96 a + 64 b + 56 c = 7,84
⇔ a = 0,05 b = 0,03 c = 0,02
Vậy n A l = 0 , 05 m o l ; n F e b đ = b + c = 0 , 05 m o l .
Đáp án C

a)
2Al + 3H2SO4 → Al2(SO4)3 +3H2
Mg + H2SO4 → MgSO4 + H2
b. n H2 = 8,96/22,4 =0,4 mol
Gọi x và y là số mol của Al và Mg ta có hệ
27x+ 24y = 7,8 (1)
1,5x+ y = 0,4 (2)
Từ 1 và 2 => x = 0,2 ; y = 0,1
Khối lượng của Al và Mg là:
mAg = 0,2.27=5,4(gam)
mMg = 7,8 – 5,4 = 2,4(gam)
c. Theo phương trình số mol của H2SO4 là : 0,3 + 0,1 = 0,4(mol)
Thể tích dung dịch H2SO4 2M đã tham gia phản ứng là:
V = 0,4/2=0,2 lít
Gọi nMg = a (mol); nAl = b (mol)
=> 24a + 27b = 7,8 (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
Mg + H2SO4 -> MgSO4 + H2
a ---> a ---> a ---> a
2Al + 3H2SO4 -> 2Al2(SO4)3 + 3H2
b ---> 1,5b ---> b ---> 1,5b
=> a + 1,5b = 0,4 (2)
(1)(2) => a = 0,1 (mol); b = 0,2 (mol)
mMg = 0,1 . 24 = 2,4 (g)
mAl = 0,2 . 27 = 5,4 (g)
nH2SO4 = 0,1 + 0,3 . 1,5 = 0,4 (mol)
VddH2SO4 = 0,3/2 = 0,2 (l)

\(PT:Fe+Cu3O_4\rightarrow FeSO_4+Cu\)
\(m\uparrow=-mFe+mCu=4\left(g\right)\)
\(nFe=\dfrac{4}{-56+64}=0,5\left(mol\right)\)
\(\Rightarrow mFe=28\left(g\right)\Rightarrow mCu=72\)

a) Fe + 2HCl --> FeCl2 + H2
b) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
_____0,15<--------------------0,15
=> mFe = 0,15.56 = 8,4 (g)
=> mCu = 15-8,4 = 6,6 (g)
c) Số nguyên tử Fe = 0,15.6.1023 = 0,9.1023



- Gọi số mol của Mg, Al là x ( mol, x > 0 )
=> \(m_{hh}=m_{Mg}+m_{Al}=a\left(g\right)\)
=> \(27x+24x=51x=a\left(g\right)\)
PTHH ( I ) : \(2Mg+O_2\rightarrow2MgO\)
.......................x..........\(\frac{1}{2}x\).........x.........
PTHH ( II ) : \(4Al+3O_2\rightarrow2Al_2O_3\)
.........................x.......\(\frac{3}{4}x\)...........\(\frac{1}{2}x\)....
Ta có : mchất rắn sau= \(m_{MgO}+m_{Al_2O_3}\)
=>mchất rắn sau= \(40x+51x=91x\left(g\right)\)
Mà mchất rắn sau - mhh = mtăng
=> \(91x-51x=4\)
=> \(40x=4\)
=> \(x=0,1\left(TM\right)\)
Vậy khối lượng hỗn hợp 2 kim loại là 51x = 51.0,1 = 5,1 ( g )