Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả thiết cả 2 lần dùng NaOH thì kết tủa đều tan 1 phần
=> Do n↓ (1)= 2 n↓ (2)
=> 4nAl3+ - nOH- (1) = 2(4nAl3+ - nOH- (2) )
=> nAl3+ = ¼ (2.nOH- (2) - nOH- (1) ) = 0,11 mol
=> m = m Al2(SO4)3 = 18,81g
=>C

Đáp án C
nNaOH (1) = 0,48 mol
nNaOH (2) = 0,51 mol
Gọi số mol A13+ trong m gam A1C13 là X
Coi 4a, 3a là số mol của Al(OH)3


Đáp án : D
, nHCl = 0,3 mol ; nNaOH = 0,32 mol ; nAl(OH)3 = 0,06 mol
Vì nNaOH > nHCl => dư OH sau khi phản ứng hết với AlCl3 => có hiện tượng hòa tan kết tủa
=> nOH tan kết tủa = nNaOH – nHCl = 0,02 mol
=> nAl(OH)3 max = 0,06 + 0,02 = 0,08 mol = nAl bđ
=> mAl = 2,16g
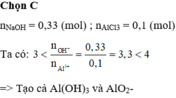
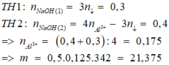




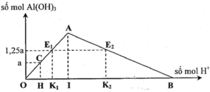



Đáp án C
n H C l = 0 , 2 m o l
Nếu cho 0,65 mol NaOH vào X thì thu được 2m gam kết tủa còn nếu thêm 0,925 mol NaOH thì thu được m gam kết tủa. Chứng tỏ lúc cho 0,925 mol NaOH thì có sự hòa tan kết tủa.
Khi cho 0,65 mol NaOH tác dụng với X thì chỉ có 0,45 mol NaOH tác dụng với AlCl3 còn khi cho 0,925 mol thì có 0,725 mol tác dụng.
Nhận thấy 0,925-0,45>0,45 do vậy lúc cho 0,65 mol NaOH thì chưa hòa tan kết tủa.
n A l ( O H ) 3 = 0 , 45 3 = 0 , 15 m o l
Do vậy lúc cho 0,925 mol NaOH thì thu được 0,075 mol kết tủa.
→ n A l C l 3 = 0 , 725 - 0 , 075 . 3 4 + 0 , 075 = 0 , 2 m o l → a = 26 , 7 g a m