Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = 2.8/56 = 0.05 (mol)
nHCl = 14.6/36.5 = 0.4 (mol)
Fe + 2HCl => FeCl2 + H2
1.........2
0.05......0.4
LTL : 0.05/1 < 0.4/2
=> HCl dư
mHCl (dư) = ( 0.4 - 0.1 ) * 36.5 = 10.95 (g)
VH2 = 0.05*22.4 = 1.12 (l)
nHCl (dư) = 0.4 - 0.1 = 0.3 (mol)
mFe cần thêm = 0.3/2 * 56 = 8.4 (g)

\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ n_{Zn} = \dfrac{13}{65} = 0,2 < n_{H_2SO_4} = \dfrac{200.24,5\%}{98} = 0,5 \to H_2SO_4\ dư\\ n_{H_2SO_4\ pư} =n_{Zn} = 0,2(mol)\\ \Rightarrow m_{H_2SO_4\ dư} = (0,5 - 0,2).98 = 29,4(gam)\\ c) n_{FeSO_4} = n_{H_2} = n_{Zn} = 0,2(mol)\\ m_{FeSO_4} = 0,2.152 = 30,4(gam)\\ V_{H_2} = 0,2.22,4 = 4,48(lít)\)

\(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH :
a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Trc p/u : 0,4 0,5
p/u: 0,25 0,5 0,25 0,25
sau p/u : 0,15 0 0,25 0,25
b, ----> sau p/ư ; Zn dư
\(m_{Zndư}=0,15.65=9,75\left(g\right)\)
PTHH :
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Từ PTHH ta có , 1 mol Al sẽ cho ra 1,5 mol H2
1 mol Fe sẽ cho ra 1 mol H2
Mà Al lại có Khối lượng mol nhỏ hơn Fe
Vậy , nếu cho cùng 1 khối lượng 2 kim loại trên thì Al sẽ cho ra nhiều H2 hơn

uiii em ơi, 2p mà viết và chụp xong luôn rồi à, nhanh thật, bái phục

\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right);n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe.dư\\ n_{H_2}=n_{Fe\left(p.ứ\right)}=n_{H_2SO_4}=0,25\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\\ b,n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(g\right)\\ m_{Fe\left(dư\right)}=0,14.56=8,4\left(g\right)\)

1.
a, \(n_{Mg}=\dfrac{3,6}{24}=0,15\left(mol\right);n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: 0,15 0,3
b, Ta có: \(\dfrac{0,15}{1}< \dfrac{0,5}{2}\) ⇒ Mg pứ hết, HCl dư
\(m_{HCldư}=\left(0,5-0,3\right).36,5=7,3\left(g\right)\)
c, \(V_{H_2}=0,15.22,4=3,36\left(l\right)\)
2.
a, \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PTHH: 4P + 5O2 ---to→ 2P2O5
Mol: 0,2 0,25 0,1
b, \(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
c, \(m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
d, \(V_{kk}=5,6.5=28\left(l\right)\)
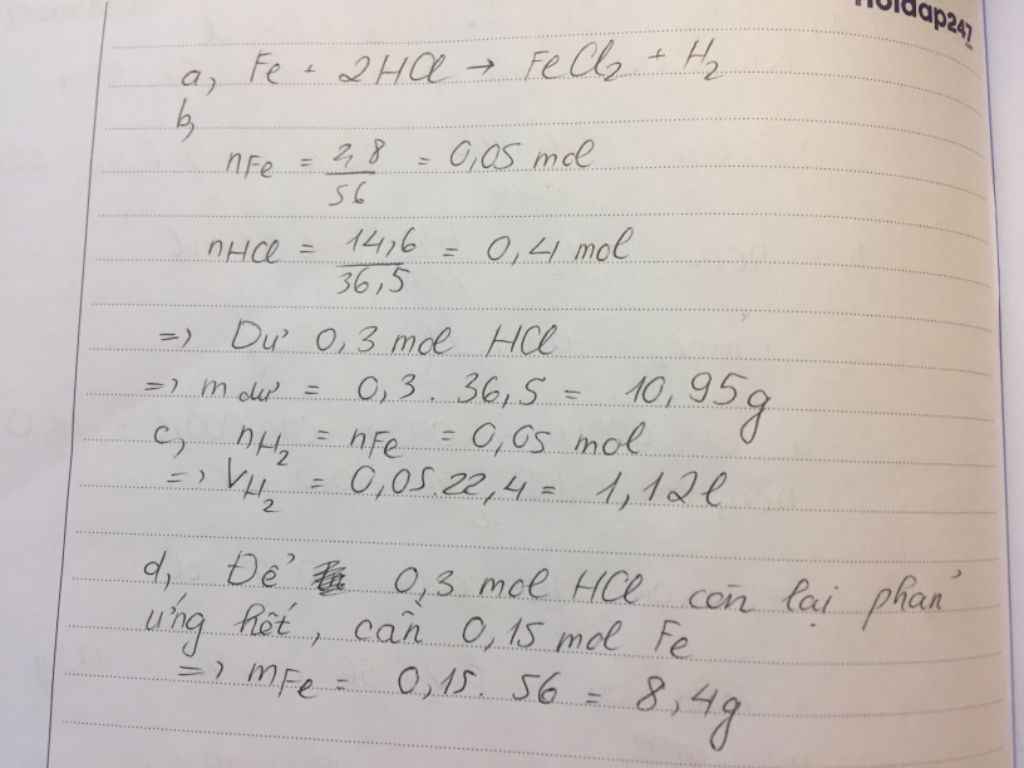
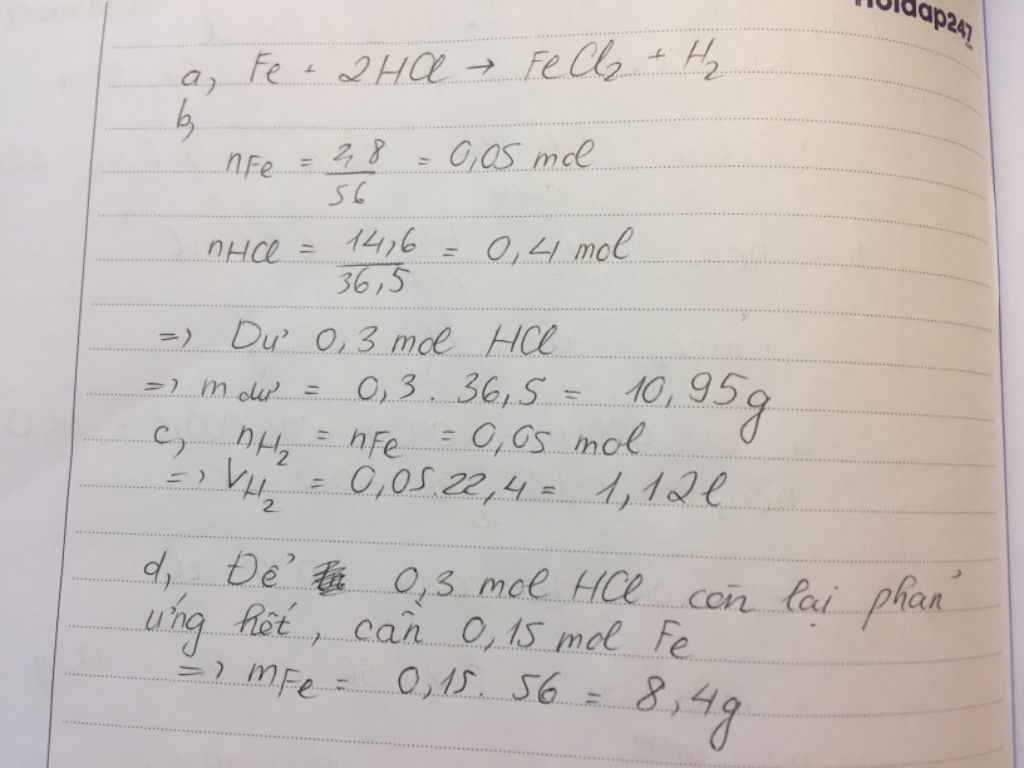


\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right);n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\\ a,Fe+2HCl\rightarrow FeCl_2+H_2\\ b,Vì:\dfrac{0,15}{1}>\dfrac{0,2}{2}\Rightarrow Fe.dư\\ n_{Fe\left(dư\right)}=0,15-\dfrac{0,2}{2}=0,05\left(mol\right)\\ m_{Fe\left(dư\right)}=0,05.56=2,8\left(g\right)\)